Wie die intestinale Mikrobiota die pro-inflammatorischen Effekte von diätetischen Emulgatoren antreibt
Emilie Viennois und Benoit ChassaingGut Microbes Volume 9, 2018 Issue 3 | Pages 289-291 | Received 18 Oct 2017, Accepted 13 Dec 2017, Published online: 13 Feb 2018
Zusammenfassung
Der Darmtrakt wird von einer großen und vielfältigen Gemeinschaft von Bakterien bewohnt, die als Darmmikrobiota bezeichnet werden. Bestehend aus 500-1000 verschiedenen Spezies, spielt die Mikrobiota eine wichtige Rolle bei Immunität und Stoffwechsel. Veränderungen in ihrer Zusammensetzung werden jedoch mit einer Vielzahl von Entzündungskrankheiten wie Fettleibigkeit, Diabetes und entzündlichen Darmerkrankungen (IBD) in Verbindung gebracht. Neben vielen anderen Faktoren hat unsere Ernährung einen Einfluss auf die Zusammensetzung und Funktion der Mikrobiota, sowohl in positiver als auch in negativer Weise. In diesem Zusammenhang werden wir unsere neuesten Erkenntnisse darüber diskutieren, wie Emulgatoren in der Nahrung die Mikrobiota direkt und nachteilig beeinflussen können, was zu entzündlichen Erkrankungen und Krebs führt.Von der Korrelation zur Beobachtung: Diätetische Emulgatoren induzieren gesundheitsschädliche Wirkung
Die intestinale Mikrobiota ist eine große und komplexe Gemeinschaft von Mikroorganismen, die 10¹⁴ Bakterien pro Darm und etwa 1000 verschiedene Arten umfasst. Unter ihren verschiedenen Funktionen ist die Darm-Mikrobiota essenziell, um die Reifung des intestinalen Immunsystems zu fördern, die Verdauung zu unterstützen und die Kalorienverwertung zu begünstigen. Neben ihren wesentlichen nützlichen Funktionen kann sich die Darmmikrobiota auch als schädlich erweisen und, wenn sie nicht gut gepflegt wird, zur Entwicklung von Entzündungskrankheiten wie der entzündlichen Darmerkrankung (IBD)1Chassaing B, Darfeuille-Michaud A. The commensal microbiota and enteropathogens in the pathogenesis of inflammatory bowel diseases. (Die kommensale Mikrobiota und Enteropathogene in der Pathogenese von entzündlichen Darmerkrankungen.) Gastroenterology. 2011; 140:1720–28. [Crossref], [PubMed], [Web of Science ®], [Google Scholar] und dem metabolischen Syndrom führen.2Chassaing B, Aitken JD, Gewirtz AT, Vijay-Kumar M. Gut microbiota drives metabolic disease in immunologically altered mice. (Darm-Mikrobiota treibt Stoffwechselerkrankung in immunologisch veränderten Mäusen an.) Adv Immunol. 2012; 116:93–112. [Crossref], [PubMed], [Web of Science ®], [Google Scholar] Entzündliche Darmerkrankungen sind schwerwiegend, schwächend und führen zu einem deutlich erhöhten Risiko, Darmkrebs zu entwickeln, von dem weltweit Millionen von Menschen betroffen sind. Das metabolische Syndrom ist ein Bündel von Erkrankungen, die mit Fettleibigkeit zusammenhängen (Bluthochdruck, Hyperglykämie, abnorme Triglycerid- und Cholesterinwerte) und die zusammen das Risiko für die Entwicklung von Typ-2-Diabetes, Herz-Kreislauf- und/oder Lebererkrankungen erheblich erhöhen.
Inmitten einer konstanten Genetik kam es in den letzten 50 Jahren zu einem dramatischen Anstieg der Inzidenz von IBD und metabolischen Syndromen. Diese rasante Entwicklung legt nahe, dass Faktoren, die mit dem Lebensstil3Suez J, Korem T, Zeevi D, Zilberman-Schapira G, Thaiss CA, Maza O, et al. Artificial sweeteners induce glucose intolerance by altering the gut microbiota. (Künstliche Süßstoffe induzieren Glukoseintoleranz durch Veränderung der Darmmikrobiota.) Nature. 2014; 514:181–6. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]4Devkota S, Chang EB. Diet-induced expansion of pathobionts in experimental colitis: implications for tailored therapies. (Diät-induzierte Expansion von Pathobionten in experimenteller Colitis: Implikationen für maßgeschneiderte Therapien.) Gut Microbes. 2013; 4:172–4. [Taylor & Francis Online], [Google Scholar] und/oder dem Einsatz von Antibiotika5Cox LM, Yamanishi S, Sohn J, Alekseyenko AV, Leung JM, Cho I, et al. Altering the intestinal microbiota during a critical developmental window has lasting metabolic consequences. (Die Veränderung der intestinalen Mikrobiota während eines kritischen Entwicklungsfensters hat nachhaltige metabolische Konsequenzen.) Cell. 2014; 158:705–21. [Crossref], [PubMed], [Web of Science ®], [Google Scholar] zusammenhängen, beteiligt sein könnten. Wir und andere haben zuvor die Hypothese aufgestellt, dass Emulgatoren, die den meisten verarbeiteten Lebensmitteln zugesetzt werden, um die Textur zu verbessern und die Haltbarkeit zu verlängern, eine Rolle bei der rasanten Zunahme dieser Krankheiten spielen könnten.6Roberts CL, Rushworth SL, Richman E, Rhodes JM. Hypothesis: Increased consumption of emulsifiers as an explanation for the rising incidence of Crohn’s disease. (Hypothese: Erhöhter Konsum von Emulgatoren als Erklärung für die steigende Inzidenz von Morbus Crohn.) J Crohns Colitis. 2013; 7:338–41. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]Roberts CL, Keita AV, Duncan SH, O’Kennedy N, Soderholm JD, Rhodes JM, et al. Translocation of Crohn’s disease Escherichia coli across M-cells: contrasting effects of soluble plant fibres and emulsifiers. (Translokation von Morbus Crohn Escherichia coli durch M-Zellen: kontrastierende Effekte von löslichen Pflanzenfasern und Emulgatoren.) Gut. 2010; 59:1331–9. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]Swidsinski A, Ung V, Sydora BC, Loening-Baucke V, Doerffel Y, Verstraelen H, et al. Bacterial overgrowth and inflammation of small intestine after carboxymethylcellulose ingestion in genetically susceptible mice. (Bakterielle Überwucherung und Entzündung des Dünndarms nach Einnahme von Carboxymethylcellulose bei genetisch anfälligen Mäusen.) Inflamm Bowel Dis. 2009; 15:359–64. [Crossref], [PubMed], [Web of Science ®], [Google Scholar] Wir haben kürzlich gezeigt, dass Emulgatoren eine chronische Darmentzündung induzieren, die die Entwicklung einer chronischen Kolitis bei anfälligen Mäusen und des metabolischen Syndroms bei Wildtyp-Mäusen fördert 7Chassaing B, Koren O, Goodrich JK, Poole AC, Srinivasan S, Ley RE, et al. Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome. (Diätetische Emulgatoren beeinflussen die Darmmikrobiota von Mäusen und fördern Colitis und metabolisches Syndrom.) Nature. 2015; 519:92–6. [Crossref], [PubMed], [Web of Science ®], [Google Scholar] Durch die Behandlung von Mäusen mit zwei häufig verwendeten Emulgatoren, nämlich Polysorbat 80 (P80) und Carboxymethylcellulose (CMC), in Dosen, die den breiten Konsum der zahlreichen Emulgatoren modellieren sollen, die in einer Vielzahl von verarbeiteten Lebensmitteln enthalten sind, beobachteten wir Veränderungen in der Spezieszusammensetzung der Darmmikrobiota und in ihrem proinflammatorischen Potenzial. Insbesondere hatte diese veränderte Mikrobiota eine erhöhte Fähigkeit, die dichte Schleimschicht zu infiltrieren, die den Darm auskleidet und die normalerweise frei von Bakterien ist. Darüber hinaus waren die Veränderungen der Mikrobiota durch eine erhöhte Expression von bakteriellen Entzündungsmolekülen wie Flagellin und Lipopolysaccharid gekennzeichnet, die wiederum die Expression von proinflammatorischen Genen durch das Immunsystem aktivieren können. Solche funktionellen Veränderungen der Mikrobiota lösten bei Mäusen, die genetisch für diese Erkrankung anfällig sind, eine chronische Kolitis aus, die auf ein gestörtes Immunsystem zurückzuführen ist. Im Gegensatz dazu induzierten Emulgatoren in Wildtyp-Mäusen mit normalem Immunsystem eine niedriggradige (d. h. milde) Darmentzündung und das metabolische Syndrom, das durch erhöhte Adipositas und Hyperglykämie gekennzeichnet ist. Darüber hinaus stellten wir fest, dass Emulgatoren die Darmmikrobiota beeinflussten und eine günstige Nische erstellten, die zu einer Verschlimmerung der Tumorentwicklung in Mausmodellen für kolorektales Karzinom führte.8Viennois E, Merlin D, Gewirtz AT, Chassaing B. Dietary emulsifier-induced low-grade inflammation promotes colon carcinogenesis. (Diätetische Emulgatoren-induzierte Low-Grade-Entzündung fördert die Kolonkarzinogenese.) Cancer Res. 2016. [Web of Science ®], [Google Scholar] Insgesamt unterstützen diese Ergebnisse das Konzept, dass eine Störung der Wirt-Mikrobiota-Beziehung eine Entzündung verursachen kann, die sich als chronische Entzündungsstörungen bei genetisch anfälligen Individuen oder als Insulinresistenz und damit verbundenes metabolisches Syndrom bei ungestörten Wirten manifestieren wird.9Blander JM, Longman RS, Iliev ID, Sonnenberg GF, Artis D. Regulation of inflammation by microbiota interactions with the host. (Regulation von Entzündungen durch Interaktionen der Mikrobiota mit dem Wirt.) Nat Immunol. 2017; 18:851–60. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]
Von der Beobachtung zum Mechanismus: Auswirkungen von Nahrungsemulgatoren auf die intestinale Mikrobiota
Als wir verstehen wollten, wie Emulgatoren mechanistisch gesehen die Gesundheit beeinträchtigen und Entzündungen fördern könnten, stellten wir fest, dass die Auswirkungen ihres Konsums in Mäusen ohne Mikrobiota (keimfrei) eliminiert waren. Wichtig war, dass die Transplantation der Mikrobiota von Emulgator-behandelten Mäusen auf Wildtyp-keimfreie Empfängermäuse ausreichte, um einige Parameter der niedriggradigen Entzündung und des metabolischen Syndroms zu übertragen, was auf eine zentrale Rolle der Mikrobiota bei der Vermittlung der Effekte hinweist. Wir haben dann gezeigt, dass eine komplexe Mikrobiota-Gemeinschaft für Emulgator-vermittelte schädliche Effekte erforderlich ist. In der Tat haben wir kürzlich beobachtet, dass der Emulgatorkonsum von gnotobiotischen Mäusen, die mit einer stark eingeschränkten Mikrobiota, bestehend aus nur 8 Bakterien, nämlich der „Altered Schaedler Flora“ (ASF),10Dewhirst FE, Chien CC, Paster BJ, Ericson RL, Orcutt RP, Schauer DB, et al. Phylogeny of the defined murine microbiota: altered Schaedler flora. (Phylogenie der definierten murinen Mikrobiota: veränderte Schaedler-Flora. ) Appl Environ Microbiol. 1999; 65:3287–92. [Crossref], [PubMed], [Web of Science ®], [Google Scholar] kolonisiert waren, nicht ausreichte, um eine Beeinträchtigung der Mikrobiota, eine Darmentzündung oder einen veränderten Stoffwechsel zu induzieren.11Chassaing B, Van de Wiele T, De Bodt J, Marzorati M, Gewirtz AT. Dietary emulsifiers directly alter human microbiota composition and gene expression ex vivo potentiating intestinal inflammation. (Diätetische Emulgatoren verändern direkt die Zusammensetzung der menschlichen Mikrobiota und die Genexpression ex vivo und potenzieren die Darmentzündung.) Gut. 2017; 66:1414Altered_Schaedler_flora–27. [Crossref], [PubMed], [Web of Science ®], [Google Scholar] Diese Ergebnisse legen nahe, dass eine komplexe Mikrobiota, die spezifische Spezies enthält, für die schädlichen Effekte von Emulgatoren erforderlich ist. Darüber hinaus deuten sie darauf hin, dass Nahrungsemulgatoren direkt auf die Mikrobiota abzielen und anscheinend wenig bis gar keine Auswirkungen auf den Wirt selbst haben. Um diese Hypothese zu demonstrieren, haben wir kürzlich mit Pr. Tom Van de Wiele von der Universität Gent (Gent, Belgien) zusammengearbeitet, der ein hochmodernes In-vitro-Mikrobiota-Modell entwickelt hat, nämlich das mucosal-simulated human intestinal microbiota ecosystem (M-SHIME)12M-SHIME – mucosal-simulated human intestinal microbiota ecosystem (M-SHIME) (M-SHIME – mukosal-simuliertes humanes intestinales Mikrobiota-Ökosystem (M-SHIME))
https://pubmed.ncbi.nlm.nih.gov/29787058/, ein dynamisches Modell, das das Lumen- und Schleim-assoziierte mikrobielle Ökosystem des menschlichen Darms simuliert.13Van den Abbeele P, Roos S, Eeckhaut V, MacKenzie DA, Derde M, Verstraete W, et al. Incorporating a mucosal environment in a dynamic gut model results in a more representative colonization by lactobacilli. (Die Einbeziehung einer mukosalen Umgebung in ein dynamisches Darmmodell führt zu einer repräsentativeren Besiedlung durch Laktobazillen.) Microb Biotechnol. 2012; 5:106–15. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]Van den Abbeele P, Belzer C, Goossens M, Kleerebezem M, De Vos WM, Thas O, et al. Butyrate-producing Clostridium cluster XIVa species specifically colonize mucins in an in vitro gut model. (Butyrat-produzierende Clostridium-Cluster XIVa-Spezies kolonisieren spezifisch Mucine in einem in vitro-Darmmodell.) ISME J. 2013; 7:949–61. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]Geirnaert A, Wang J, Tinck M, Steyaert A, Van den Abbeele P, Eeckhaut V, et al. Interindividual differences in response to treatment with butyrate-producing Butyricicoccus pullicaecorum 25-3T studied in an in vitro gut model. (Interindividuelle Unterschiede in der Reaktion auf die Behandlung mit Butyrat-produzierendem Butyricicoccus pullicaecorum 25-3T, untersucht in einem in vitro Darmmodell.) FEMS Microbiol Ecol. 2015; 91. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]14Dietary exposures for the safety assessment of seven emulsifiers commonly added to foods in the United States and implications for safety (Diätetische Expositionen für die Sicherheitsbewertung von sieben Emulgatoren, die üblicherweise in den Vereinigten Staaten Lebensmitteln zugesetzt werden, und Auswirkungen auf die Sicherheit) Romina Shah et al. Food Additives & Contaminants: Part A Published online: 19 Apr 2017 Unter Verwendung dieses in vitro Mikrobiota-Modells konnten wir zeigen, dass sowohl P80 als auch CMC direkt auf eine einzelne menschliche Mikrobiota einwirkten, um die Mikrobiota-Zusammensetzung und/oder die Genexpression (gemessen mit einem meta-transkriptomischen Ansatz) zu verändern. Dieses Ergebnis deutet darauf hin, dass die Mikrobiota ein direktes Ziel dieser häufig verwendeten Lebensmittelzusatzstoffe ist.15Van den Abbeele P, Roos S, Eeckhaut V, MacKenzie DA, Derde M, Verstraete W, et al. Incorporating a mucosal environment in a dynamic gut model results in a more representative colonization by lactobacilli. (Die Einbeziehung einer mukosalen Umgebung in ein dynamisches Darmmodell führt zu einer repräsentativeren Besiedlung durch Laktobazillen.) Microb Biotechnol. 2012; 5:106–15. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]Van den Abbeele P, Belzer C, Goossens M, Kleerebezem M, De Vos WM, Thas O, et al. Butyrate-producing Clostridium cluster XIVa species specifically colonize mucins in an in vitro gut model. (Butyrat-produzierende Clostridium-Cluster XIVa-Spezies kolonisieren spezifisch Mucine in einem in vitro-Darmmodell.) ISME J. 2013; 7:949–61. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]Geirnaert A, Wang J, Tinck M, Steyaert A, Van den Abbeele P, Eeckhaut V, et al. Interindividual differences in response to treatment with butyrate-producing Butyricicoccus pullicaecorum 25-3T studied in an in vitro gut model. (Interindividuelle Unterschiede in der Reaktion auf die Behandlung mit Butyrat-produzierendem Butyricicoccus pullicaecorum 25-3T, untersucht in einem in vitro Darmmodell.) FEMS Microbiol Ecol. 2015; 91. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]16Dietary exposures for the safety assessment of seven emulsifiers commonly added to foods in the United States and implications for safety (Diätetische Expositionen für die Sicherheitsbewertung von sieben Emulgatoren, die üblicherweise in den Vereinigten Staaten Lebensmitteln zugesetzt werden, und Auswirkungen auf die Sicherheit) Romina Shah et al.Food Additives & Contaminants: Part A Published online: 19 Apr 2017 Konkret zeigte diese Studie, dass sowohl P80 als auch CMC das pro-inflammatorische Potenzial der menschlichen Mikrobiota erhöhten, was sich in erhöhten Spiegeln von bioaktivem Flagellin zeigte. Der CMC-induzierte Anstieg von Flagellin war schnell (1 Tag) und wurde durch ein verändertes Transkriptom der Mikrobiota angetrieben. Im Gegensatz dazu erfolgte der P80-induzierte Flagellin-Anstieg allmählich und war eng mit der veränderten Zusammensetzung der Mikrobiota verbunden. Wichtig ist, dass beide mit Emulgatoren behandelten M-SHIME-Mikrobiota bei der Übertragung auf keimfreie Empfängertiere die meisten der Wirts- und mikrobiellen Veränderungen induzierten, die bei direkt mit Emulgatoren behandelten Mäusen beobachtet wurden (Abbildung 1). Daher demonstrieren diese Ergebnisse ein neuartiges Paradigma der Dekonstruktion von Wirt-Mikrobiota-Interaktionen und weisen darauf hin, dass die Mikrobiota durch diese häufig verwendeten Lebensmittelzusatzstoffe direkt beeinflusst werden kann, und zwar in einer Weise, die in der Folge zu Darmentzündungen führt.
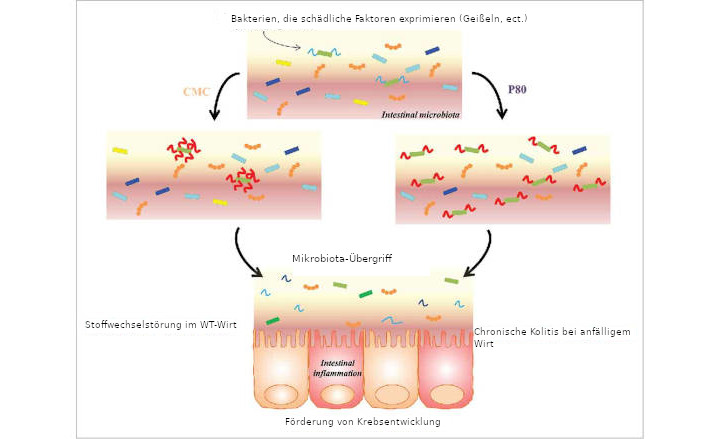
Abbildung 1. Nahrungsemulgatoren wirken sich direkt auf die intestinale Mikrobiota aus und erhöhen deren proinflammatorisches Potenzial. Carboxymethylcellulose (CMC) wirkt sich direkt auf die bakterielle Genexpression aus und führt zu einer erhöhten Expression von Molekülen mit proinflammatorischem Potenzial. Polysorbat 80 (P80) verändert die Zusammensetzung der Mikrobiota und begünstigt die Ausbreitung von Bakterien mit proinflammatorischem Potenzial. In beiden Fällen ist diese veränderte Mikrobiota in der Lage, die normalerweise sterile Schleimschicht zu durchdringen, was zu einer Darmentzündung führt, die sich bei genetisch anfälligen Personen als chronische Entzündungserkrankung oder bei ungeschädigten Wirten als Insulinresistenz und damit verbundenes metabolisches Syndrom manifestiert. Darüber hinaus prädisponiert eine veränderte Mikrobiota nach Emulgatorexposition für die Entwicklung von Dickdarmkrebs.

Schlussfolgerungen und zukünftige Richtungen
Zusammenfassend konnten wir zeigen, dass Nahrungsemulgatoren direkt auf die Darmmikrobiota einwirken und deren Fähigkeit erhöhen, die normalerweise sterile Schleimschicht zu durchdringen, was bei Wildtyp-Wirten zu Darmentzündungen und metabolischem Syndrom führt. Unsere Forschung widerspricht zwar nicht der allgemein verbreiteten Annahme, dass übermäßiges Essen eine zentrale Ursache für Fettleibigkeit und das metabolische Syndrom ist, aber diese Ergebnisse verstärken das Konzept, das durch frühere Arbeiten nahegelegt wurde, dass eine niedriggradige Entzündung, die aus einer veränderten Mikrobiota resultiert, eine zugrunde liegende Ursache für übermäßiges Essen sein kann.17Hotamisligil GS. Inflammation and metabolic disorders. (Entzündungen und Stoffwechselstörungen.) Nature. 2006; 444:860–7. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]18Hotamisligil GS. Inflammation and endoplasmic reticulum stress in obesity and diabetes. (Entzündung und Stress des endoplasmatischen Retikulums bei Adipositas und Diabetes.) Int J Obes. 2008; 32(Suppl 7):S52–4. [Crossref], [Google Scholar]
In den kommenden Jahren sollten die molekularen Mechanismen untersucht werden, durch die Emulgatoren die Bakterien beeinflussen, da es entscheidend sein wird zu verstehen, wie solche Verbindungen von der Darmmikrobiota wahrgenommen werden und zu einer veränderten Zusammensetzung und Genexpression führen können. Während wir bisher nur einen Spender im M-SHIME-Modell verwendet haben, um die Wirkung von Emulgatoren zu vergleichen (Variable = Emulgator, Konstante = Spender), sollten weitere Experimente die interindividuellen Variationen in der Reaktion auf die Emulgatorbehandlung analysieren, indem mehrere Spender verwendet werden (Variable = Spender, Konstante = Emulgator). Ein solcher Ansatz sollte die Identifizierung von „anfälligen“ und „resistenten“ Mikrobiota ermöglichen, mit der Identifizierung von Schlüsselbakterienspezies, die die nachfolgende Entzündung verursachen. Wenn diese spezifischen Bakterien identifiziert sind, wird es wichtig sein, den Mechanismus zu verstehen, durch den sie eine Entzündung auslösen können. Sind diese Bakterien in der Lage, in Gegenwart von Emulgatoren an Darmepithelzellen zu haften und/oder in diese einzudringen? Welche bakteriellen Organellen/sezernierten Faktoren beeinflussen die Entzündungsreaktion des Wirts? Welche Wirtsstoffwechselwege werden aktiviert?
Während wir zuvor berichtet haben, dass das Ausschalten der Emulgatorexposition bei Mäusen ausreichte, um die meisten der schädlichen Effekte umzukehren, wird es wichtig sein zu entschlüsseln, wie eine normale Wirt-Mikrobiota-Beziehung wiederhergestellt werden kann. Es bleibt zum Beispiel unklar, ob die Entfernung des Emulgators ausreicht, um die Mikrobiota in einen gesunden Zustand zu versetzen, der mit einem verringerten Risiko für die Entwicklung von Dickdarmkrebs verbunden ist. Zusätzlich und angesichts der Tatsache, dass lösliche Ballaststoffe wie Inulin oder das Präbiotikum Akkermansia muciniphila dafür bekannt sind, die Schleimsekretion zu begünstigen,19Everard A, Belzer C, Geurts L, Ouwerkerk JP, Druart C, Bindels LB, et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity. (Cross-Talk zwischen Akkermansia muciniphila und Darmepithel kontrolliert diät-induzierte Adipositas.) Proc Natl Acad Sci U S A. 2013; 110:9066–71. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]20Zou J, Chassaing B, Singh V, Pellizzon M, Ulman E, Ricci M, et al. Fiber-mediated nourishment of gut microbiota protects against diet-induced obesity by restoring IL-22-mediated colonic health (Ballaststoff-vermittelte Ernährung der Darm-Mikrobiota schützt vor diät-induzierter Fettleibigkeit durch Wiederherstellung der IL-22-vermittelten Darmgesundheit) Cell Host Microbe 2017; in press. [Google Scholar] sollte die Verwendung von Präbiotika oder Probiotika bei mit Emulgatoren behandelten Tieren als therapeutischer Ansatz erforscht werden.
Darüber hinaus bleibt der genaue Mechanismus, durch den die veränderte Mikrobiota die Entzündung antreibt, unklar und erfordert weitere Untersuchungen. Darüber hinaus schließen die direkten Effekte, die diese Substanzen auf die Mikrobiota haben, die Möglichkeit nicht aus, dass sie auch direkte Effekte auf die Integrität der Schleimschicht und/oder auf die Darmschleimhaut haben. In diesem Zusammenhang bleibt es wichtig, die Schlüsselbakterienarten zu identifizieren, die die intestinale Entzündung und die damit verbundenen Störungen verursachen. Zu diesem Zweck sollten die Bakterien, die die Schleimschicht infiltrieren („Schleim-Invasoren“), der Mechanismus, durch den sie dies tun können, und der Mechanismus, durch den sie anschließend zu einer Darmentzündung und einem veränderten Stoffwechsel führen, identifiziert werden. Schließlich ist eine Übertragung unserer Erkenntnisse von der Maus auf den Menschen erforderlich, z. B. durch eine diätetische Intervention und die Untersuchung der Auswirkungen einer solchen Verbindung auf die menschliche Mikrobiota, die Darmentzündung und den Stoffwechsel.
Danksagungen
E.V. ist Empfänger des Career Development Award der Crohn’s and Colitis Foundation. B.C. ist Empfänger des Career Development Award der Crohn’s and Colitis Foundation und eines Innovator Award der Rainin Foundation. Wir danken Samantha Spencer (Georgia State University) für die Bearbeitung des Manuskripts.
Offenlegung von potenziellen Interessenkonflikten
Es wurden keine potenziellen Interessenkonflikte offengelegt.
Zusätzliche Informationen
Finanzierung
Morbus Crohn und Colitis Stiftung, CDA, Rainin Stiftung, Innovator Award
Lizenzierung
© 2018 Der/die Autor(en). Veröffentlicht mit Lizenz von Taylor & FrancisEmilie Viennois und Benoit Chassaing
Dies ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Attribution – Namensnennung – Nicht kommerziell – Keine Bearbeitungen 4.0 International CC BY-NC-ND 4.0 verbreitet wird, die die nicht-kommerzielle Wiederverwendung, Verbreitung und Vervielfältigung in jedem Medium erlaubt, vorausgesetzt, das Originalwerk wird ordnungsgemäß zitiert und nicht verändert, umgewandelt oder in irgendeiner Weise darauf aufgebaut.
Schlüsselwörter:
Emulgatoren, Mikrobiota, Schleimhautinvasoren, Entzündung, metabolisches Syndrom, Krebs
Um diesen Artikel zu zitieren:
Emilie Viennois & Benoit Chassaing (2018) First victim, later aggressor: How the intestinal microbiota drives the pro-inflammatory effects of dietary emulsifiers?, Gut Microbes, 9:3, 289-291, DOI: 10.1080/19490976.2017.1421885
Verwandte Forschung
Dietary exposures for the safety assessment of seven emulsifiers commonly added to foods in the United States and implications for safety (closed source)
Romina Shah et al.
Food Additives & Contaminants: Part A
Published online: 19 Apr 2017
Food processing, gut microbiota and the globesity problem (closed source)
Lisa Miclotte et al.
Critical Reviews in Food Science and Nutrition
Published online: 4 Apr 2019
Info-Krümel
Die Bewertungs-Funktion ist derzeit deaktiviert!
Materialien zur Verfügung gestellt durch: Gut Microbes Volume 9, 2018 Issue 3 | Pages 289-291 | Received 18 Oct 2017, Accepted 13 Dec 2017, Published online: 13 Feb 2018
Die Studie wurde von uns ohne weitere Veränderungen aus dem Englischen übersetzt.
Journal-Referenz:
Gut Microbes Volume 9, 2018 – Ausgabe 3 | Seiten 289-291
Tooltips:
Die Texte in eventuell vorhandenen Tooltip-Fenstern wurden von der Redaktion des W3punkt.de bereitgestellt, sie entstammen in der Hauptsache den englisch- und deutschsprachigen Wikipedias.
Das Titelbild ist ein Teil der Studie und unterliegt desselben Copyrights.
DEN BEITRAG WEITERVERWENDEN
© 2018 Der/die Autor(en). Veröffentlicht mit Lizenz von Taylor & FrancisEmilie Viennois und Benoit Chassaing
Dies ist ein Open-Access-Artikel, der unter den Bedingungen der Creative Commons Attribution – Namensnennung – Nicht kommerziell – Keine Bearbeitungen 4.0 International CC BY-NC-ND 4.0 verbreitet wird, die die nicht-kommerzielle Wiederverwendung, Verbreitung und Vervielfältigung in jedem Medium erlaubt, vorausgesetzt, das Originalwerk wird ordnungsgemäß zitiert und nicht verändert, umgewandelt oder in irgendeiner Weise darauf aufgebaut.
Quellen und Tiefen
- 1Chassaing B, Darfeuille-Michaud A. The commensal microbiota and enteropathogens in the pathogenesis of inflammatory bowel diseases. (Die kommensale Mikrobiota und Enteropathogene in der Pathogenese von entzündlichen Darmerkrankungen.) Gastroenterology. 2011; 140:1720–28. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]
- 2Chassaing B, Aitken JD, Gewirtz AT, Vijay-Kumar M. Gut microbiota drives metabolic disease in immunologically altered mice. (Darm-Mikrobiota treibt Stoffwechselerkrankung in immunologisch veränderten Mäusen an.) Adv Immunol. 2012; 116:93–112. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]
- 3Suez J, Korem T, Zeevi D, Zilberman-Schapira G, Thaiss CA, Maza O, et al. Artificial sweeteners induce glucose intolerance by altering the gut microbiota. (Künstliche Süßstoffe induzieren Glukoseintoleranz durch Veränderung der Darmmikrobiota.) Nature. 2014; 514:181–6. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]
- 4Devkota S, Chang EB. Diet-induced expansion of pathobionts in experimental colitis: implications for tailored therapies. (Diät-induzierte Expansion von Pathobionten in experimenteller Colitis: Implikationen für maßgeschneiderte Therapien.) Gut Microbes. 2013; 4:172–4. [Taylor & Francis Online], [Google Scholar]
- 5Cox LM, Yamanishi S, Sohn J, Alekseyenko AV, Leung JM, Cho I, et al. Altering the intestinal microbiota during a critical developmental window has lasting metabolic consequences. (Die Veränderung der intestinalen Mikrobiota während eines kritischen Entwicklungsfensters hat nachhaltige metabolische Konsequenzen.) Cell. 2014; 158:705–21. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]
- 6Roberts CL, Rushworth SL, Richman E, Rhodes JM. Hypothesis: Increased consumption of emulsifiers as an explanation for the rising incidence of Crohn’s disease. (Hypothese: Erhöhter Konsum von Emulgatoren als Erklärung für die steigende Inzidenz von Morbus Crohn.) J Crohns Colitis. 2013; 7:338–41. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]Roberts CL, Keita AV, Duncan SH, O’Kennedy N, Soderholm JD, Rhodes JM, et al. Translocation of Crohn’s disease Escherichia coli across M-cells: contrasting effects of soluble plant fibres and emulsifiers. (Translokation von Morbus Crohn Escherichia coli durch M-Zellen: kontrastierende Effekte von löslichen Pflanzenfasern und Emulgatoren.) Gut. 2010; 59:1331–9. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]Swidsinski A, Ung V, Sydora BC, Loening-Baucke V, Doerffel Y, Verstraelen H, et al. Bacterial overgrowth and inflammation of small intestine after carboxymethylcellulose ingestion in genetically susceptible mice. (Bakterielle Überwucherung und Entzündung des Dünndarms nach Einnahme von Carboxymethylcellulose bei genetisch anfälligen Mäusen.) Inflamm Bowel Dis. 2009; 15:359–64. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]
- 7Chassaing B, Koren O, Goodrich JK, Poole AC, Srinivasan S, Ley RE, et al. Dietary emulsifiers impact the mouse gut microbiota promoting colitis and metabolic syndrome. (Diätetische Emulgatoren beeinflussen die Darmmikrobiota von Mäusen und fördern Colitis und metabolisches Syndrom.) Nature. 2015; 519:92–6. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]
- 8Viennois E, Merlin D, Gewirtz AT, Chassaing B. Dietary emulsifier-induced low-grade inflammation promotes colon carcinogenesis. (Diätetische Emulgatoren-induzierte Low-Grade-Entzündung fördert die Kolonkarzinogenese.) Cancer Res. 2016. [Web of Science ®], [Google Scholar]
- 9Blander JM, Longman RS, Iliev ID, Sonnenberg GF, Artis D. Regulation of inflammation by microbiota interactions with the host. (Regulation von Entzündungen durch Interaktionen der Mikrobiota mit dem Wirt.) Nat Immunol. 2017; 18:851–60. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]
- 10Dewhirst FE, Chien CC, Paster BJ, Ericson RL, Orcutt RP, Schauer DB, et al. Phylogeny of the defined murine microbiota: altered Schaedler flora. (Phylogenie der definierten murinen Mikrobiota: veränderte Schaedler-Flora. ) Appl Environ Microbiol. 1999; 65:3287–92. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]
- 11Chassaing B, Van de Wiele T, De Bodt J, Marzorati M, Gewirtz AT. Dietary emulsifiers directly alter human microbiota composition and gene expression ex vivo potentiating intestinal inflammation. (Diätetische Emulgatoren verändern direkt die Zusammensetzung der menschlichen Mikrobiota und die Genexpression ex vivo und potenzieren die Darmentzündung.) Gut. 2017; 66:1414Altered_Schaedler_flora–27. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]
- 12M-SHIME – mucosal-simulated human intestinal microbiota ecosystem (M-SHIME) (M-SHIME – mukosal-simuliertes humanes intestinales Mikrobiota-Ökosystem (M-SHIME))
https://pubmed.ncbi.nlm.nih.gov/29787058/ - 13Van den Abbeele P, Roos S, Eeckhaut V, MacKenzie DA, Derde M, Verstraete W, et al. Incorporating a mucosal environment in a dynamic gut model results in a more representative colonization by lactobacilli. (Die Einbeziehung einer mukosalen Umgebung in ein dynamisches Darmmodell führt zu einer repräsentativeren Besiedlung durch Laktobazillen.) Microb Biotechnol. 2012; 5:106–15. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]Van den Abbeele P, Belzer C, Goossens M, Kleerebezem M, De Vos WM, Thas O, et al. Butyrate-producing Clostridium cluster XIVa species specifically colonize mucins in an in vitro gut model. (Butyrat-produzierende Clostridium-Cluster XIVa-Spezies kolonisieren spezifisch Mucine in einem in vitro-Darmmodell.) ISME J. 2013; 7:949–61. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]Geirnaert A, Wang J, Tinck M, Steyaert A, Van den Abbeele P, Eeckhaut V, et al. Interindividual differences in response to treatment with butyrate-producing Butyricicoccus pullicaecorum 25-3T studied in an in vitro gut model. (Interindividuelle Unterschiede in der Reaktion auf die Behandlung mit Butyrat-produzierendem Butyricicoccus pullicaecorum 25-3T, untersucht in einem in vitro Darmmodell.) FEMS Microbiol Ecol. 2015; 91. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]
- 14Dietary exposures for the safety assessment of seven emulsifiers commonly added to foods in the United States and implications for safety (Diätetische Expositionen für die Sicherheitsbewertung von sieben Emulgatoren, die üblicherweise in den Vereinigten Staaten Lebensmitteln zugesetzt werden, und Auswirkungen auf die Sicherheit) Romina Shah et al. Food Additives & Contaminants: Part A Published online: 19 Apr 2017
- 15Van den Abbeele P, Roos S, Eeckhaut V, MacKenzie DA, Derde M, Verstraete W, et al. Incorporating a mucosal environment in a dynamic gut model results in a more representative colonization by lactobacilli. (Die Einbeziehung einer mukosalen Umgebung in ein dynamisches Darmmodell führt zu einer repräsentativeren Besiedlung durch Laktobazillen.) Microb Biotechnol. 2012; 5:106–15. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]Van den Abbeele P, Belzer C, Goossens M, Kleerebezem M, De Vos WM, Thas O, et al. Butyrate-producing Clostridium cluster XIVa species specifically colonize mucins in an in vitro gut model. (Butyrat-produzierende Clostridium-Cluster XIVa-Spezies kolonisieren spezifisch Mucine in einem in vitro-Darmmodell.) ISME J. 2013; 7:949–61. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]Geirnaert A, Wang J, Tinck M, Steyaert A, Van den Abbeele P, Eeckhaut V, et al. Interindividual differences in response to treatment with butyrate-producing Butyricicoccus pullicaecorum 25-3T studied in an in vitro gut model. (Interindividuelle Unterschiede in der Reaktion auf die Behandlung mit Butyrat-produzierendem Butyricicoccus pullicaecorum 25-3T, untersucht in einem in vitro Darmmodell.) FEMS Microbiol Ecol. 2015; 91. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]
- 16Dietary exposures for the safety assessment of seven emulsifiers commonly added to foods in the United States and implications for safety (Diätetische Expositionen für die Sicherheitsbewertung von sieben Emulgatoren, die üblicherweise in den Vereinigten Staaten Lebensmitteln zugesetzt werden, und Auswirkungen auf die Sicherheit) Romina Shah et al.Food Additives & Contaminants: Part A Published online: 19 Apr 2017
- 17Hotamisligil GS. Inflammation and metabolic disorders. (Entzündungen und Stoffwechselstörungen.) Nature. 2006; 444:860–7. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]
- 18Hotamisligil GS. Inflammation and endoplasmic reticulum stress in obesity and diabetes. (Entzündung und Stress des endoplasmatischen Retikulums bei Adipositas und Diabetes.) Int J Obes. 2008; 32(Suppl 7):S52–4. [Crossref], [Google Scholar]
- 19Everard A, Belzer C, Geurts L, Ouwerkerk JP, Druart C, Bindels LB, et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity. (Cross-Talk zwischen Akkermansia muciniphila und Darmepithel kontrolliert diät-induzierte Adipositas.) Proc Natl Acad Sci U S A. 2013; 110:9066–71. [Crossref], [PubMed], [Web of Science ®], [Google Scholar]
- 20Zou J, Chassaing B, Singh V, Pellizzon M, Ulman E, Ricci M, et al. Fiber-mediated nourishment of gut microbiota protects against diet-induced obesity by restoring IL-22-mediated colonic health (Ballaststoff-vermittelte Ernährung der Darm-Mikrobiota schützt vor diät-induzierter Fettleibigkeit durch Wiederherstellung der IL-22-vermittelten Darmgesundheit) Cell Host Microbe 2017; in press. [Google Scholar]