Die Alzheimer-Krankheit (lateinisch Morbus Alzheimer) oder Alzheimersche Krankheit ist eine neurodegenerative Erkrankung, die in ihrer häufigsten Form bei Personen über dem 65. Lebensjahr auftritt und durch zunehmende Demenz gekennzeichnet ist. Sie ist für ungefähr 60 Prozent der weltweit etwa 24 Millionen Demenzerkrankungen verantwortlich.1C. P. Ferri et al.: Global prevalence of dementia: a Delphi consensus study. In: Lancet, Band 366, Nr. 9503, Dezember 2005, S. 2112–2117, doi:10.1016/S0140-6736(05)67889-0. PMID 16360788. PMC 2850264 (freier Volltext). Die Alzheimer-Krankheit beziehungsweise die Alzheimer-Demenz wird umgangssprachlich oft kurz als „Alzheimer“ bezeichnet.
Die Krankheit ist nach dem Arzt Alois Alzheimer benannt, der sie im Jahr 1906 erstmals beschrieb, nachdem er im Gehirn einer verstorbenen Patientin charakteristische Veränderungen festgestellt hatte.
| Klassifikation nach ICD-10 | |
| G30.0† F00.0* |
Demenz bei Alzheimer-Krankheit, mit frühem Beginn (Typ 2) |
| G30.0† F00.0* |
Demenz bei Alzheimer-Krankheit, mit spätem Beginn (Typ 1) |
| G30.8† F00.2* |
Demenz bei Alzheimer-Krankheit, atypische oder gemischte Form |
| G30.9† F00.9* |
Demenz bei Alzheimer-Krankheit, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) |
Überschriften einblenden ≡
Abgrenzung: „Alzheimer“ und „Demenz“
Die Begriffe Alzheimer und Demenz können und müssen klar voneinander unterschieden werden: Demenz ist der Oberbegriff für verschiedene Erkrankungen des Gehirns und wird in der wissenschaftlichen Diskussion anhand diagnostischer Kriterien klar beschrieben, unter anderem in der ICD-10. Gemeinsam ist allen Demenzen der zunehmende Verlust kognitiver, emotionaler und sozialer Fähigkeiten. Die Alzheimer-Demenz ist eine Form von Demenz, nach dem derzeitigen wissenschaftlichen Kenntnisstand die häufigste und im Allgemeinen die bekannteste Form. Die wissenschaftliche Fachwelt ist sich weitgehend darin einig, dass mindestens 60 % aller Demenzerkrankungen auf der Alzheimer-Krankheit beruhen.2Elisabeth Stechl, Catarina Knüvener et al.: Praxishandbuch Demenz. Erkennen – Verstehen – Behandeln. Mabuse-Verlag, Frankfurt am Main 2012, ISBN 978-3-86321-038-0.3R. Mahlberg, H. Gutzmann (Hrsg.): Demenzerkrankungen erkennen, behandeln und versorgen. Deutscher Ärzte-Verlag, Köln 2009, ISBN 978-3-7691-0563-6. Eine Gleichsetzung der Begriffe Alzheimer und Demenz ist irreführend und sollte vermieden werden.
Die Alzheimer-Demenz zählt zu den sogenannten primären Demenzen, bei denen das demenzielle Verhalten (kognitive Veränderungen etc.) direkt auf Gehirnveränderungen zurückzuführen ist. Ursächlich für sekundäre Demenzen sind dagegen Mangelerscheinungen, Verletzungen oder Vergiftungen (Medikamentenmissbrauch, Alkoholabusus).4Sabine Engel: Alzheimer und Demenzen. Unterstützung für Angehörige. Trias-Verlag, Stuttgart 2012, ISBN 978-3-8304-3983-7. Im Gegensatz zu einigen sekundären Demenzen ist die Alzheimer-Demenz wie auch die anderen primären Demenzen (vaskuläre Demenz, Lewy-Body-Demenz u. a.) nach dem derzeitigen Kenntnisstand nicht reversibel.5R. Mahlberg, H. Gutzmann (Hrsg.): Demenzerkrankungen erkennen, behandeln und versorgen. Deutscher Ärzte-Verlag, Köln 2012, ISBN 978-3-7691-0563-6.
Auftreten der Alzheimer-Krankheit
Charakterisierung und Symptome beim Menschen
Charakteristisch ist eine zunehmende Verschlechterung der kognitiven Leistungsfähigkeit, die in der Regel einhergeht mit einer Abnahme der Fähigkeit, die Aktivitäten des täglichen Lebens zu bewältigen, mit zunehmenden Verhaltensauffälligkeiten und verstärkt auftretenden neuropsychiatrischen Symptomen.
Bereits viele Jahre bevor erste klinische Symptome sichtbar werden, bilden sich im Gehirn des Betroffenen Plaques, die aus fehlerhaft gefalteten Beta-Amyloid-(Aβ-)Peptiden bestehen. Zusammen mit den Plaques sind Neurofibrillen, die sich in Form von Knäueln in den Neuronen ablagern, kennzeichnend (pathognomonisch) für die Erkrankung. Morbus Alzheimer gehört zu den Tauopathien, da sich bei dieser neurodegenerativen Erkrankung fehlerhafte Tau-Proteine aus dem Zellkörper heraus an die Axone anlagern und nicht mehr zurück in den Zellkörper können und die Zellen bis zur Unfähigkeit hin einschränken.
Die zugrundeliegenden Veränderungen sind zurzeit nicht behandelbar.
Häufigkeit
Von Alzheimer sind fast ausschließlich Menschen höheren Alters betroffen. Durch die Bevölkerungsentwicklung in den westlichen Industrienationen mit immer älter werdenden Bürgern steigt daher auch die Alzheimer-Prävalenz. Von den 65-Jährigen sind etwa zwei Prozent betroffen, bei den 70-Jährigen sind es bereits drei Prozent, bei den 75-Jährigen sechs Prozent und bei den 85-Jährigen zeigen etwa 20 Prozent Symptome der Krankheit. Über dem 85. Lebensjahr nimmt der Anteil der Betroffenen wieder ab, da die zuvor Erkrankten nur selten dieses Lebensalter erreichen. Der jüngste bisher bekannte Alzheimer-Patient erkrankte mit 27 Jahren und starb mit 33.6Skript (Memento vom 21. September 2008 im Internet Archive) (PDF; 612 kB) der Sendung Quarks & Co zum Thema Alzheimer Die bei Kindern und Jugendlichen auftretende Neuronale Ceroid-Lipofuszinose wird oft als Kinder-Alzheimer bezeichnet, ist aber eine erbliche Stoffwechselerkrankung.
Frauen erkranken deutlich häufiger an Alzheimer als Männer. Ein Grund hierfür ist die höhere Lebenserwartung. In den letzten Jahren werden zudem Zusammenhänge zwischen Schwankungen im Hormonhaushalt während der Menopause und dem Risiko, an Alzheimer zu erkranken, erforscht.7Alexandra Bröhm: Warum Frauen häufiger an Alzheimer erkranken. In: welt.de. Axel Springer SE, 31. Mai 2016, abgerufen am 30. Dezember 20198Jane Gilmore: A possible ‘link’ between menopause and Alzheimer’s is scaring women, including me. In: The Sydney Morning Herald. 7. Juni 2019, abgerufen am 30. Dezember 2019 (englisch).
In Deutschland leiden aktuell (2018) etwa 1,7 Millionen Menschen unter einer Demenzerkrankung, bis 2050 wird ein Anstieg auf 3 Millionen prognostiziert. Mehr als 25.000 von ihnen haben noch nicht das 65. Lebensjahr erreicht. Jedes Jahr werden etwa 300.000 neue Demenzerkrankungen diagnostiziert, von denen mindestens zwei Drittel vom Alzheimertyp sind.9Deutsche Alzheimer Gesellschaft e. V.: Die Häufigkeit von Demenzerkrankungen. (PDF) Infoblatt 1. In: deutsche-alzheimer.de. Juni 2018, abgerufen am 9. August 2019.
Im Jahr 2015 waren nach Schätzungen von Alzheimer’s Disease International weltweit etwa 46,8 Millionen Menschen von Demenz betroffen. Die Alzheimer-Krankheit stellt auch global mit etwa 65 % die häufigste Form der Demenz dar. Nach Auswertung von Computermodellen soll sich diese Zahl, die auf Bevölkerungsprognosen der Vereinten Nationen basiert, bis zum Jahr 2050 auf rund 131,5 Millionen Patienten erhöhen.10World Alzheimer Report 2015. The Global Impact of Dementia. (PDF) An analysis of prevalence, Incidence, cost and trends. Alzheimer’s Disease International (ADI), August 2015, abgerufen am 9. August 2019 (englisch).
Alzheimersymptome bei Tieren
Aufgrund verbesserter veterinärmedizinischer Versorgung erreichen auch Haustiere ein höheres Lebensalter. Neuropathologische Veränderungen (Plaques und vaskuläre Amyloidose) z. B. im Hirn seniler Hunde ähneln den Befunden von an Alzheimer erkrankten Menschen. Die Folge dieser Prozesse sind kognitive Funktionsstörungen, die zu übersteigerter Angst, Desorientierung, scheinbar grundloser Aggression, verringerter oder fehlender Lernfähigkeit und Verlust der Stubenreinheit führen können. Das Xanthin-Derivat Propentofyllin, das den Adenosintransport hemmt und die Hämodynamik verbessert, wird in der geriatrischen Therapie mit Hunden erfolgreich eingesetzt.11D. Kapl, K. A. Rudolphi: Neue pharmakologische Aspekte zum neurologischen Profil von Propentofyllin. In: Tierärztliche Praxis (26)(K), 1998, S. 317–321
Ursachen
Bis heute ist die Ursache der Alzheimer-Erkrankung nicht vollständig geklärt, auch wenn weitgehende, allerdings nicht vollständige Einigkeit über die möglichen Einflussfaktoren auf die Krankheitsentstehung herrscht.12“Die Ursachen der Alzheimer-Krankheit sind bislang nicht vollständig geklärt. Die bisherige Forschung zeigt, dass an ihrer Entstehung mehrere Faktoren beteiligt sind.” In: Elisabeth Stechl, Catarina Knüvener et al.: Praxishandbuch Demenz. Erkennen – Verstehen – Behandeln. Mabuse-Verlag, Frankfurt am Main 2012, ISBN 978-3-86321-038-0., S. 19213“Obgleich die Ätiologie der Alzheimer-Demenz letztlich weiterhin als ungeklärt bezeichnet werden muss, gab es doch in den letzten Jahren einen deutlichen Wissenszuwachs in der Pathologie der Erkrankung, in erster Linie auf der Basis von genetischen und molekularbiologischen Untersuchungen.” In: R. Mahlberg, H. Gutzmann (Hrsg.): Demenzerkrankungen erkennen, behandeln und versorgen. Deutscher Ärzte-Verlag, Köln 2009, ISBN 978-3-7691-0563-6., S. 11 f.14J. J. Iliff et al.: Impairment of glymphatic pathway function promotes tau pathology after traumatic brain injury. In: The Journal of neuroscience: the official journal of the Society for Neuroscience. Band 34, Nr. 49, Dezember 2014, S. 16180–16193, doi:10.1523/JNEUROSCI.3020-14.2014, PMID 25471560, PMC 4252540 (freier Volltext).
Unterfunktion der Ausschwemmung von Abfallstoffen aus dem Gehirn
→ Hauptartikel: Glymphatisches System
Im Zuge der Entdeckung (2012) des glymphatischen Systems, eines speziellen Mikrokreislaufs in Gehirn und Rückenmark zur Ausschwemmung von überflüssigem und schädlichem Material, zeigte sich, dass dieses System eine Schlüsselrolle bei der Entstehung der Alzheimer-Krankheit – und möglicherweise auch bei zukünftiger Vorbeugung und Behandlung – einzunehmen scheint.
Ablagerungen von Beta-Amyloiden, der so genannten senilen Plaques, im Zellzwischenraum (Interstitium) werden durch das glymphatische System abtransportiert. Bei Mäusen war der Abtransport der Beta-Amyloiden während des Schlafs doppelt so schnell wie während der Wachphasen. Dies wurde in Verbindung gebracht mit dem erhöhten Risiko von Personen mit Schlafstörungen, an Alzheimer zu erkranken. Auch die Zunahme des Erkrankungsrisikos im Alter wurde in Verbindung gebracht mit dem entsprechenden, altersbedingten Leistungsabfall des glymphatischen Systems.15J. M. Tarasoff-Conway et al.: Clearance systems in the brain-implications for Alzheimer disease. In: Nature reviews. Neurology. Band 11, Nr. 8, August 2015, S. 457–470, doi:10.1038/nrneurol.2015.119, PMID 26195256, PMC 4694579 (freier Volltext) (Review). Bestimmte pathogene, für Alzheimer charakteristische, Formen von Tau-Proteinen werden ebenfalls durch das glymphatische System aus dem Zellzwischenraum abtransportiert.16J. J. Iliff et al.: Impairment of glymphatic pathway function promotes tau pathology after traumatic brain injury. In: The Journal of neuroscience: the official journal of the Society for Neuroscience. Band 34, Nr. 49, Dezember 2014, S. 16180–16193, doi:10.1523/JNEUROSCI.3020-14.2014, PMID 25471560, PMC 4252540 (freier Volltext).
Genetische Risikofaktoren
Auf genetischer Ebene wurde eine Variante im Gen für das ApoE identifiziert, die einen Risikofaktor für die Entwicklung einer Alzheimer-Erkrankung darstellt. Darüber hinaus wurden kausale Mutationen in drei verschiedenen Genen gefunden [Präsenilin-1 und -2 und Amyloid-Precursor-Protein (APP, Amyloid-Vorläuferprotein)], die als Auslöser der seltenen früh auftretenden Unterform gelten. Die Veränderungen in allen drei Genen führen dazu, dass sich früher als bei der nichterblichen-sporadischen Form große Mengen von Beta-Amyloid zunächst im Assoziationscortex (zuständig für höhere kognitive Prozesse) und im Hippocampus (Gedächtnisbildung) und später im gesamten Gehirn anhäufen.17Demenz vom Alzheimer-Typ (DAT) – Diagnostik und Therapie Ihr Anteil an der Entstehung von Alzheimer (population attributable risk) wird auf maximal 30 % geschätzt. In einer Studie an 1700 isländischen Patienten wurde eine natürliche Mutation im APP-Gen entdeckt, die mit der Abwesenheit von Alzheimer und Demenz assoziiert war.18T. Jonsson et al.: A mutation in APP protects against Alzheimer’s disease and age-related cognitive decline. In: Nature. Band 488, Nr. 7409, August 2012, S. 96–99, doi:10.1038/nature11283. PMID 22801501.
Vererbung
Es gibt eine genetische Komponente in der Verursachung der Alzheimer-Krankheit. Etwa fünf bis zehn Prozent der Betroffenen zeigen eine familiäre Häufung, die auf Mutationen des Präsenilin-1-Gens (PSEN1) auf Chromosom 14, des Präsenilin-2-Gens (PSEN2) auf Chromosom 1 oder des APP-Gens auf Chromosom 21 zurückzuführen sind. Zusätzlich konnte eine noch unklare Verbindung zwischen der Alzheimerschen Erkrankung und dem ε4-Allel von Apolipoprotein E (ApoE), einem am Cholesterin-Transport beteiligten Protein, hergestellt werden.
Das Down-Syndrom mit seiner dreifachen Anlage von Erbmaterial des Chromosoms 21, auf dem sich das APP-Gen befindet, erhöht ebenfalls das Risiko, an einer Demenz, evtl. der Alzheimer-Krankheit, zu erkranken, wobei der Nachweis bei Menschen mit dieser Genommutation durch eine meist vorliegende kognitive Beeinträchtigung erschwert wird.
Weiterhin ist eine Mutationsvariante des SORL1-Gens als erhöhter Risikofaktor für diese Erkrankung genannt worden.19E. Rogaeva et al.: The neuronal sortilin-related receptor SORL1 is genetically associated with Alzheimer disease. In: Nature genetics. Band 39, Nr. 2, Februar 2007, S. 168–177, doi:10.1038/ng1943. PMID 17220890. PMC 2657343 (freier Volltext).
Eine Punktmutation von GAA zu GCA in Exon 8 im PSEN1-Gen, die zu einem Aminosäureaustausch von Glutaminsäure zu Alanin im Genprodukt führt, ist für ein gehäuftes Auftreten von FAD im kolumbianischen Departamento de Antioquia verantwortlich. Der Gendefekt wird autosomal–dominant vererbt.20F. Lopera et al.: Clinical features of early-onset Alzheimer disease in a large kindred with an E280A presenilin-1 mutation. In: JAMA. Band 277, Nr. 10, März 1997, S. 793–799, PMID 9052708.21Pam Belluck: Alzheimer’s Stalks a Colombian Family. In: nytimes.com. 1. Juni 2010, abgerufen am 27. Juli 2015 (englisch). Diese Mutation hat ihren Ausgangspunkt bei einem Paar baskischer Einwanderer, das sich Anfang des 18. Jahrhunderts in Kolumbien niederließ. Man geht von etwa 1000 Mutationsträgern aus. Die Mutation wird nach dem Namen der Bewohner dieser Gegend auch Paisa-Mutation genannt. Erste Symptome von Gedächtnisverlust machen sich typischerweise bereits in der dritten Lebensdekade bemerkbar. Leichte kognitive Beeinträchtigungen beginnen im Alter von 45 und Demenz im Alter von 50 Jahren.22PSEN1 E280A (Paisa). In: alzforum.org. Abgerufen am 27. Juli 2015 (englisch). Über einen Gentest kann die Prädisposition für die Alzheimer-Erkrankung nachgewiesen werden. Diese Patienten sind als Teilnehmer für klinische Studien zur Erprobung potenzieller Alzheimermedikamente besonders gut geeignet. Es wurde eine umfangreiche Phase-II-Langzeitstudie mit Patienten gestartet, die eine Paisa-Mutation aufweisen. Sie erhielten prophylaktisch den monoklonalen Antikörper Crenezumab.23Andreas Kleinschmidt: Alzheimer Früherkennung. In: siemens.com. 15. April 2013, abgerufen am 27. Juli 2015. Crenezumab ist gegen Beta-Amyloid-40 und -42 gerichtet.24. Panza et al.: Amyloid-based immunotherapy for Alzheimer’s disease in the time of prevention trials: the way forward. In: Expert review of clinical immunology. Band 10, Nr. 3, März 2014, S. 405–419, doi:10.1586/1744666X.2014.883921, PMID 24490853 (Review).25F. Panza et al.: Is there still any hope for amyloid-based immunotherapy for Alzheimer’s disease? In: Current opinion in psychiatry. Band 27, Nr. 2, März 2014, S. 128–137, doi:10.1097/YCO.0000000000000041, PMID 24445401 (Review). Die Studie begann 2013 und sollte bis zum Jahr 2020 laufen.26Klinische Studie (Phase II): A Study of Crenezumab Versus Placebo in Preclinical PSEN1 E280A Mutation Carriers to Evaluate Efficacy and Safety in the Treatment of Autosomal-Dominant Alzheimer Disease, Including a Placebo-Treated Noncarrier Cohort. bei Clinicaltrials.gov der NIH Im Januar 2019 gab Roche jedoch bekannt, dass die Studien zu Crenezumab frühzeitig eingestellt wurden, da die beabsichtigte Wirkung nicht eingetroffen sei.27Klinische Studie (Phase I): A Multiple Ascending Dose Study of COR388 bei Clinicaltrials.gov der NIH
Entzündliche Prozesse oder Infektion
Die Nonnenstudie von David Snowdon zeigt als unerwartetes Ergebnis die Unabhängigkeit des pathologischen Gehirnbefunds (multiple Alzheimer-Plaques) von der wiederholt erhobenen intellektuellen Leistungsfähigkeit derselben Personen zu Lebzeiten. Pat McGeer vermutet entzündliche Prozesse im Gehirn als Ursache der Erkrankung. Thomas Bayer sieht die ursächlichen Prozesse in den Nervenzellen.
Beta-Amyloid-Proteine zeigen in vitro eine starke antimikrobielle Wirkung. Eine Vermutung ist, dass sie als Defensivantwort bei einer noch unbekannten Infektion entstehen.28S. J. Soscia et al.: The Alzheimer’s disease-associated amyloid beta-protein is an antimicrobial peptide. In: PloS one. Band 5, Nr. 3, 2010, S. e9505, doi:10.1371/journal.pone.0009505. PMID 20209079. PMC 2831066 (freier Volltext).
Eine im Januar 2019 veröffentlichte Studie vermutet einen Zusammenhang zwischen der Alzheimer-Krankheit und Infektionen mit der Bakterienart Porphyromonas gingivalis, die mit Parodontitis in Verbindung steht. Indizien dafür sind das Vorkommen von P. gingivalis und dessen Stoffwechselprodukten, den sogenannten Gingipainen, in den Gehirnen von Alzheimer-Patienten. Gingipaine sind Proteasen, die in der Studie in vitro als auch in vivo die Struktur von Tau-Proteinen beeinflussen. Die Infektion von Mäusen mit Porphyromonas gingivalis führte zu Amyloidose. In der Studie konnten mit zwei Proteaseinhibitoren die Gingipaine inhibiert werden, was wiederum die Anzahl der Bakterien im Gehirn der Versuchstiere (Farbmäuse) reduzierte, die Produktion von Aβ1–42 blockierte und die Entzündungsprozesse, die zu neurodegenerativen Veränderungen führten, ebenfalls reduzieren.29Stephen S. Dominy et al.: Porphyromonas gingivalis in Alzheimer’s disease brains: Evidence for disease causation and treatment with small-molecule inhibitors In: Science Advances. Band 5, Nr. 1, 2019, Der in der Studie verwendete Inhibitor COR388 befindet sich seit Dezember 2017 in einer klinischen Phase-I-Studie mit gesunden Probanden.30Klinische Studie (Phase I): Study of COR388 HCl in Healthy Subjects bei Clinicaltrials.gov der NIH Eine weitere, randomisierte, Placebo-kontrollierte, Doppelblindstudie in Phase I mit Alzheimer-Patienten wurde im Februar 2018 begonnen.31Klinische Studie (Phase I): A Multiple Ascending Dose Study of COR388 bei Clinicaltrials.gov der NIH
Prionen als Auslöser
Forschungen deuten darauf hin, dass eine Alzheimer-artige Tauopathie bei genetisch veränderten Mäusen durch Einbringen synthetischer Tau-Fibrillen ins Gehirn ausgelöst werden kann.32Michiyo Iba, Jing L. Guo, Jennifer D. McBride, Bin Zhang, John Q. Trojanowski und Virginia M.-Y. Lee: Synthetic Tau Fibrils Mediate Transmission of Neurofibrillary Tangles in a Transgenic Mouse Model of Alzheimer’s-Like Tauopathy In: The Journal of Neuroscience. Nr. 33, 16. Januar 2013, S. 1024–1037.
Risikofaktoren Cholesterin, Trauma, Diabetes und Bluthochdruck
Als Risikofaktoren gelten – neben dem unvermeidbaren Altern und genetischer Disposition – ein vorangegangenes Schädel-Hirn-Trauma,33R. Mayeux, R. Ottman, M. Tang, L. Noboa-Bauza, K. Marder, B. Gurland, Y. Stern: Genetic susceptibility and head injury as risk factors for Alzheimer’s disease among community-dwelling elderly persons and their first-degree relatives. In: Ann Neurol. Band 33, Nr. 5, 1993, S. 494–501, PMID 8498827. Stoffwechselerkrankungen – Insulinresistenz und Hyperinsulinämie,34K. F. Neumann, L. Rojo, L. P. Navarrete, G. Farías, P. Reyes, R. B. Maccioni: Insulin resistance and Alzheimer’s disease: molecular links & clinical implications. In: Curr Alzheimer Res.:. Nr. 5 (5), Oktober 2008, S. 438–447, PMID 18855585.35J. S. Roriz-Filho, T. M. Sá-Roriz, I. Rosset, A. L. Camozzato, A. C. Santos, M. L. Chaves, J. C. Moriguti, M. Roriz-Cruz: (Pre)diabetes, brain aging, and cognition. In: Biochim Biophys Acta. 2009, S. 432–443, PMID 19135149.36W. Q. Qiu, M. F. Folstein: Insulin, insulin-degrading enzyme and amyloid-beta peptide in Alzheimer’s disease: review and hypothesis. In: Neurobiol Aging. Feb; 27 (2), 2006, S. 190–198, PMID 19135149. Diabetes37O. S. Kofman, V. H. Macmillan: Diffuse cerebral atrophy. In: Applied therapeutics. Band 12, Nr. 4, April 1970, S. 24–26, PMID 5446326.und hohe Cholesterin-Werte38M. Crisby, L. Carlson, B. Winblad: Statins in the prevention and treatment of Alzheimer disease. In: Alzheimer Disease & Associated Disorders. Band 16, Nr. 3, 2002, S. 131–136, PMID 12218642. sowie Erkrankungen des kardiovaskulären Systems – Bluthochdruck39P. Kehoe, G. Wilcock: Is inhibition of the renin-angiotensin system a new treatment option for Alzheimer’s disease? In: Lancet neurology. Band 6, Nr. 4, 2007, S. 373–378, PMID 17362841. und erlittene Schlaganfälle.40„Why stroke ups Alzheimer’s risk“ BBC, vom 4. Juni 2007
Aluminium im Gehirn: Folge oder Ursache von Alzheimer?
Siehe auch: Aluminium#Toxizität
Aluminium wurde mehrfach kontrovers als auslösender Faktor im Zusammenhang mit der Alzheimer-Krankheit diskutiert. Es ist ein häufiges Element und taucht natürlich u. a. als Spurenelement in Lebensmitteln und im Trinkwasser auf. Zusätzliche Expositionen ergeben sich durch die Verwendung in z. B. Antazida (Magaldrat, Hydrotalcit), Deodorants und Aluminium-Kochgeschirr.
Bei einem Vorfall mit Aluminiumsulfat im Trinkwasser in Camelford in Cornwall in England trank im Juli 1988 eine Reihe von Menschen Trinkwasser mit größeren Konzentrationen von Aluminiumsulfat. Die Untersuchungen der langfristigen Auswirkungen auf die Gesundheit nach diesem Vorfall sind noch immer nicht vollständig abgeschlossen, aber es wurden in Post-Mortem-Untersuchungen besonders stark erhöhte Aluminium-Konzentrationen in den Gehirnen der Opfer festgestellt und weitere Untersuchungen in Auftrag gegeben, um einen Zusammenhang mit zerebraler Amyloidangiopathie festzustellen.41Nigel Hawkes: Alzheimers linked to aluminium pollution in tap water. In: The Times. 20. April 2006, abgerufen am 7. April 2010.
In der französischen PAQUID-Kohortenstudie aus dem Jahr 1999 und späteren Aktualisierungen wurde ein möglicher Zusammenhang zwischen Aluminium-Einlagerungen durch belastetes Trinkwasser und der Wahrscheinlichkeit, an Alzheimer zu erkranken, hergestellt.42Virginie Rondeau, Daniel Commenges, Hélène Jacqmin-Gadda, Jean-François Dartigues: Relation between Aluminum Concentrations in Drinking Water and Alzheimer’s Disease: An 8-year Follow-up Study. In: Am J Epidemiology. 2000, PMID 10901330 (Online).43V. Rondeau, H. Jacqmin-Gadda, D. Commenges, C. Helmer, J.-F. Dartigues: Aluminum and Silica in Drinking Water and the Risk of Alzheimer’s Disease or Cognitive Decline: Findings From 15-Year Follow-up of the PAQUID Cohort. In: American Journal of Epidemiology. Band 169, Nr. 4, 2008, S. 489–496, doi:10.1093/aje/kwn348, PMID 19064650, PMC 2809081 (freier Volltext). Demnach wurden viele senile Plaques mit erhöhten Aluminiumwerten in Gehirnen von Alzheimer-Patienten gefunden.44Sakae Yumoto, Shigeo Kakimi, Akihiro Ohsaki, Akira Ishikawa: Demonstration of aluminum in amyloid fibers in the cores of senile plaques in the brains of patients with Alzheimer’s disease. In: Journal of Inorganic Biochemistry. Band 103, Nr. 11, 2009, S. 1579–84, doi:10.1016/j.jinorgbio.2009.07.023, PMID 19744735.
Nach einer Metastudie von Ferreira et al. aus dem Jahr 2008 von 34 relevanten Studien stellten 68 % einen Zusammenhang zwischen Aluminium und Alzheimer her, während 8,5 % keinen Zusammenhang fanden. 23,5 % kamen zu keinem deutlichen Ergebnis.45P. C. Ferreira, A. Piai Kde, A. M. Takayanagui, S. I. Segura-Muñoz: Aluminum as a risk factor for Alzheimer’s disease. In: Rev Lat Am Enfermagem. Band 16, Nr. 1, 2008, S. 151–157, doi:10.1590/S0104-11692008000100023, PMID 18392545 (Online).
Die britische Alzheimer-Gesellschaft vertrat am 30. Januar 2009 den medizinischen und wissenschaftlichen Standpunkt, dass die bis 2008 erstellten Studien einen kausalen Zusammenhang zwischen Aluminium und der Alzheimer-Krankheit nicht überzeugend nachgewiesen haben.46Alzheimer’s Society: Aluminium and Alzheimer’s disease. (PDF) In: The Learning Exchange. Juni 2002, abgerufen am 9. August 2019 (englisch).
Eine gesundheitliche Bewertung des Bundesinstitutes für Risikobewertung (BfR) aus dem Jahre 2005 sah keinen Zusammenhang zwischen der Aluminiumaufnahme aus Lebensmittelbedarfsgegenständen und der Alzheimer-Krankheit, ebenso wenig eine Aktualisierung aus dem Jahr 2007, jedoch wurde die Empfehlung abgegeben, vorsorglich keine sauren Speisen in Kontakt mit Aluminiumtöpfen oder -folie aufzubewahren.47Bundesinstituts für Risikobewertung: Keine Alzheimer-Gefahr durch Aluminium aus Bedarfsgegenständen (PDF; 8 Seiten, 65 kB), am 4. Oktober 2013. Die Ergebnisse einer Stellungnahme der Europäischen Behörde für Lebensmittelsicherheit (EFSA) zu Aluminium als Lebensmittelzutat (im Stoff E131), die im April 2013 veröffentlicht wurde, werden in einer neuen Stellungnahme des BfR berücksichtigt. Auch hier wird darauf hingewiesen, dass der Zusammenhang zur Alzheimer-Krankheit bisher nicht bewiesen ist, die geschätzte Aufnahmemenge von Aluminium bei täglicher Anwendung aluminiumhaltiger Antitranspirante liege aber über der wöchentlich tolerierbaren Menge der EFSA.48Bundesinstitut für Risikobewertung: Aluminiumhaltige Antitranspirantien tragen zur Aufnahme von Aluminium bei. (PDF; 15 Seiten), am 10. März 2014
Feinstaub
Eine Studie aus dem Jahr 2018 zeigt einen Zusammenhang zwischen Feinstaub (PM2,5) sowie Ozon (O3) und Alzheimer. Dabei wurden 203 Bewohner von Mexiko-Stadt untersucht. Es wurde u. a. die Häufigkeit von Tauopathien und Beta-Amyloid untersucht. Die Exposition gegenüber Feinstaub und Ozon über den USEPA–Grenzwerten kann der Studie zufolge mit einem erhöhten Alzheimer-Risiko in Verbindung gebracht werden.49Lilian Calderón-Garcidueñas et al.: Hallmarks of Alzheimer disease are evolving relentlessly in Metropolitan Mexico City infants, children and young adults. APOE4 carriers have higher suicide risk and higher odds of reaching NFT stage V at ≤ 40 years of age. In: Environmental Research, 164, 2018, S. 475, doi:10.1016/j.envres.2018.03.023.
Krankheitsverlauf
Senile Plaques und Mitochondrien-Störung
Im Gehirn von Alzheimer-Patienten bilden sich senile Plaques und fibrilläre Ablagerungen. Die Proteinablagerungen der Plaques bestehen im Wesentlichen aus dem Beta-Amyloid-Peptid. Die intrazellulär gelegenen Neurofibrillenbündel bestehen aus dem Tau-Protein. Dieses aggregiert zu Fibrillen, wenn es stärker als normal phosphoryliert, d. h. mit Phosphorsäureresten besetzt ist („Hyperphosphorylierung“). Es ist ungeklärt, ob diese Tau-Phosphorylierung sekundärer Natur oder krankheitsauslösend ist.
Spaltung des APP durch α-, β- und γ-Sekretase(n) von Maksim CC BY-SA 3.0 Link
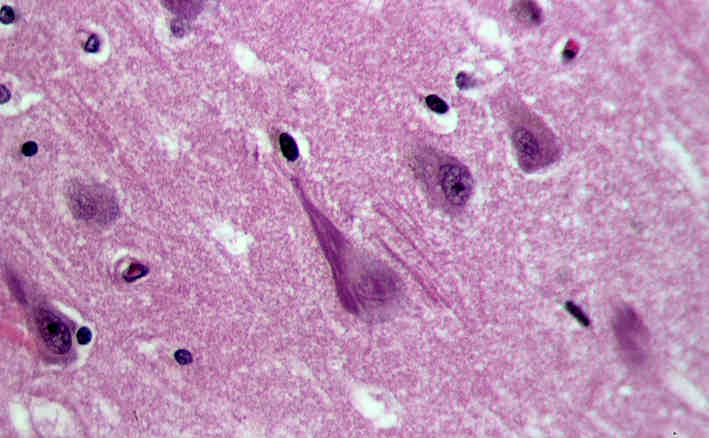
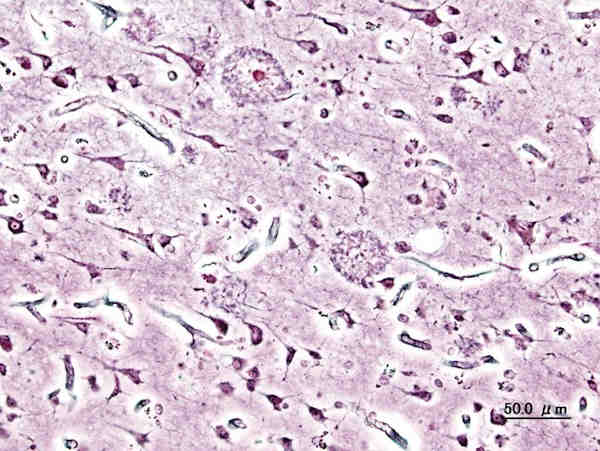 Feingeweblicher Schnitt mit Alzheimer-typischen senilen Plaques, Versilberung. Von User:KGH – Eigenes Werk, CC BY-SA 3.0, Link
Feingeweblicher Schnitt mit Alzheimer-typischen senilen Plaques, Versilberung. Von User:KGH – Eigenes Werk, CC BY-SA 3.0, Link
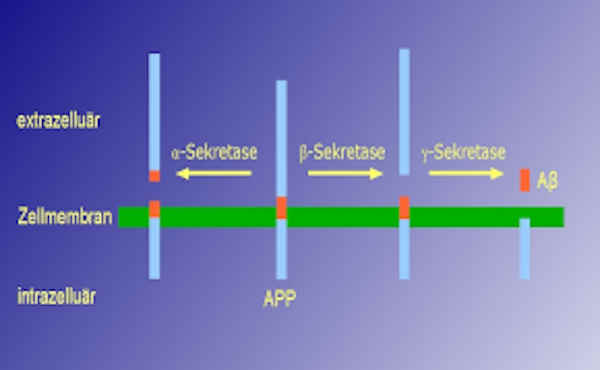
Das Beta-Amyloid-Peptid entsteht aus einem Vorläuferprotein, dem Amyloid-Precursor-Protein (APP), bei dem es sich um ein integrales Membranprotein handelt. Der größte Anteil dieses Proteins ragt aus der Zelle heraus (befindet sich extrazellulär; siehe Extrazelluläre Matrix), während sich nur ein kleiner Anteil innerhalb der Zelle befindet (intrazellulär). Es handelt sich um ein Typ I-Transmembranprotein: Der Amino-Terminus befindet sich auf der Zellaußenseite, der Carboxyl-Terminus innerhalb der Zelle. APP wird von proteinspaltenden Enzymen, den sogenannten Sekretasen (Alpha-Sekretasen, Beta-Sekretase und Gamma-Sekretase) gespalten, wodurch es zur Freisetzung des Beta-Amyloid-Peptids aus dem Vorläuferprotein kommen kann. Grundsätzlich gibt es zwei Wege, wie APP gespalten werden kann:
- Der nicht-amyloidogene Weg: APP wird durch eine α-Sekretase geschnitten. Dieser Schnitt findet innerhalb des Teils von APP statt, der Beta-Amyloid enthält. Dadurch wird die Bildung von Beta-Amyloid verhindert. Es kommt zur Freisetzung eines großen extrazellulären Anteils, dessen Funktion noch nicht endgültig geklärt ist.
- Der amyloidogene Weg: APP wird zuerst von der β-Sekretase geschnitten und nachfolgend von der γ-Sekretase. Dieser Schnitt, der innerhalb der Transmembrandomäne erfolgt, führt zur Freisetzung von Beta-Amyloid.
Kandidaten für die α-Sekretase sind die Proteasen ADAM 10, ADAM17/TACE und für die β-Sekretase BACE1. Die γ-Sekretase besteht aus einem hochmolekularen Komplex aus den Proteinen Präsenilin 1 bzw. 2, PEN-2, APH-1 und Nicastrin, wobei nicht geklärt ist, ob nicht noch weitere Proteine daran beteiligt sind.
Bei der Alzheimer-Erkrankung ist die Funktion der Mitochondrien gestört. Eine Blockade der Atmungskette am Komplex IV führt zu einer übermäßigen Produktion von Radikalen, die die Zelle schädigen können. Ob diese Blockade eine Konsequenz der übermäßigen Beta-Amyloid-Produktion ist oder ob Beta-Amyloid als Antioxidans gegen diesen neu entstandenen oxidativen Stress übermäßig produziert wird, war 2014 noch offen.
Früherkennung
Als Alzheimer-Früherkennung wird u. a. eine Untersuchung der Hirnleistung mittels verschiedener Tests angeboten oder auch eine Kernspintomographie (MRT). Beides ist eine Privatleistung, also eine IGeL (Individuelle Gesundheitsleistung). Der IGeL-Monitor des MDS (Medizinischer Dienst des Spitzenverbandes Bund der Krankenkassen) hat den Hirnleistungs-Check zur Früherkennung einer Demenz mit „tendenziell negativ“ bewertet, da kein wirklicher Nutzen erkennbar ist. Es lässt sich weder eine Demenz durch frühes Erkennen verhindern oder abmindern, und da nur die Hälfte der Menschen mit leichter Demenz später eine schwere entwickelt, werden möglicherweise Patienten unnötig beunruhigt.50Hirnleistungs-Check zur Früherkennung einer Demenz. IGeL-Monitor; abgerufen am 15. Januar 2019. Wichtigste Quellen darin: Meta-Analyse Tsoi 2016. – KK Tsoi, HW Hirai, JY Chan, TC. Kwok: Time to Treatment Initiation in People With Alzheimer Disease: A Meta-Analysis of Randomized Controlled Trials. In: Journal of the American Medical Directors Association, 2016, 17, S. 24–30, PMID 26392193; sowie Systematisches Review Lin et al. 2013 – J. S. Lin, E. O’Connor, R. C. Rossom, L. A. Perdue, E. Eckstrom: Screening for cognitive impairment in older adults: A systematic review for the U.S. Preventive Services Task Force. In: Annals of internal medicine, 2013, 159, S. 601–612, PMID 24354019. Mehr zur Begründung der Bewertung in Evidenz kompakt. (PDF) abgerufen am 15. Januar 2019. Auch die S3-Leitlinie „Demenzen“ von 2016 spricht sich gegen eine Untersuchung von Personen ohne Beschwerden oder Symptome aus.51AWMF: S3-Leitlinie “Demenzen”. Abgerufen am 7. Januar 2021.
Die Kernspintomographie (MRT) zur Früherkennung einer Alzheimer-Demenz hat der IGeL-Monitor aus ähnlichen Gründen ebenfalls mit „tendenziell negativ“ bewertet. Zwar sei die Kernspin- oder Magnetresonanztomographie (MRT) ein wertvolles Verfahren, das helfen könne, eine Alzheimer-Demenz zu diagnostizieren. Es gebe aber keine Studien zum Nutzen einer Früherkennung per MRT.52MRT zur Früherkennung einer Alzheimer-Demenz. IGeL-Monitor; abgerufen am 15. Januar 2019. Wichtigste Quellen darin: NICE-Leitlinie von 2011. (National Institute for Health and Clinical Excellence der britischen Gesundheitsbehörde NHS) sowie Meta-Analyse Schmand et al. 2010. – B. Schmand, H. M. Huizenga, W. A. van Gool: Meta-analysis of CSF and MRI biomarkers for detecting preclinical Alzheimer’s disease. In: Psychological Medicine, Januar 2010, 40 (1): S. 135–145, PMID 19863841. Mehr zur Begründung der Bewertung in der Evidenzsynthese. (PDF) abgerufen am 15. Januar 2019.
Bei einem Verdacht auf Alzheimer-Demenz bezahlen die gesetzlichen Krankenkassen die Abklärung des Verdachts, unter Umständen auch mit einer MRT. Ein Hirnleistungs-Check ist Kassenleistung für Menschen, bei denen ein begründeter Verdacht auf eine Demenz besteht, bei Menschen zwischen 70 und 80 Jahren mit bestimmten weiteren Erkrankungen, sowie allgemein bei Menschen über 80 Jahren. Die Angebote der Selbstzahlerleistung wurden in verschiedenen Medien kritisch aufgegriffen.53Artikel aus dem Tagesspiegel. vom 21. Februar 2018 oder aus der Ärzte-Zeitung. vom 5. Dezember 2017.
Erkennen der Krankheit durch Verhalten der Menschen
Erste Warnzeichen
Das amerikanische National Institute on Aging hat sieben Warnzeichen formuliert, die auf eine beginnende Alzheimersche Krankheit hinweisen können und welche die Menschen in der nahen Umgebung veranlassen sollten, ärztlichen Rat einzuholen:54G. B. Frisoni et al.: Revised criteria for Alzheimer’s disease: what are the lessons for clinicians? In: The Lancet. Neurology. Band 10, Nr. 7, Juli 2011, S. 598–601, doi:10.1016/S1474-4422(11)70126-0. PMID 21683925.
- Der Erkrankte wiederholt immer wieder die gleiche Frage.
- Der Erkrankte erzählt immer wieder die gleiche kurze Geschichte.
- Der Erkrankte weiß nicht mehr, wie bestimmte alltägliche Verrichtungen wie Kochen, Kartenspiel, Handhabung der TV-Fernbedienung funktionieren.
- Der Erkrankte hat den sicheren Umgang mit Geld, Überweisungen, Rechnungen und Ähnlichem verloren.
- Der Erkrankte findet viele Gegenstände nicht mehr oder er legt sie an ungewöhnliche Plätze (unabsichtliches Verstecken) und verdächtigt andere Personen, den vermissten Gegenstand weggenommen zu haben.
- Der Erkrankte vernachlässigt anhaltend sein Äußeres, bestreitet dies aber.
- Der Erkrankte antwortet auf Fragen, indem er die ihm gestellte Frage wiederholt.
Prä-Demenz-Stadium
Bereits acht Jahre bevor Alzheimer sicher diagnostiziert werden kann, sind geringe Auffälligkeiten in neuropsychologischen Tests nachweisbar.56R. T. Linn et al.: The ‘preclinical phase’ of probable Alzheimer’s disease. A 13-year prospective study of the Framingham cohort. In: Arch Neurol. Band 52, Nr. 5, 1995, S. 485–490, PMID 7733843.57J. Saxton et al.: Preclinical Alzheimer disease: neuropsychological test performance 1.5 to 8 years prior to onset. In: Neurology. Band 63, Nr. 12, 2004, S. 2341–2347, PMID 15623697.58E. W. Twamley, S. A. Ropacki, M. W. Bondi: Neuropsychological and neuroimaging changes in preclinical Alzheimer’s disease. In: J Int Neuropsychol Soc. Band 12, Nr. 5, 2006, S. 707–735, doi:10.1017/S1355617706060863, PMID 16961952. Probleme mit dem Kurzzeitgedächtnis und damit in Verbindung stehende Probleme, neue Information aufzufassen, sind dabei am leichtesten zu erkennen. Unter Umständen kommt es bereits zu leichten Beeinträchtigungen beim Sprachverständnis und der persönlichen Zieleverfolgung. Beeinträchtigungen des Affekts wie Depression und Teilnahmslosigkeit sind üblich.
Erkennen der Krankheit durch wissenschaftliche Methoden
Vom „National Institute on Aging“ und der US-Alzheimer-Gesellschaft wurden im April 2011 neue Empfehlungen zu Diagnose der Alzheimer-Krankheit veröffentlicht.59G. B. Frisoni et al.: Revised criteria for Alzheimer’s disease: what are the lessons for clinicians? In: The Lancet. Neurology. Band 10, Nr. 7, Juli 2011, S. 598–601, doi:10.1016/S1474-4422(11)70126-0. PMID 21683925. Diese überarbeiteten Diagnose-Kriterien werden aber als noch ungeeignet für den allgemeinen klinischen Alltag angesehen und sollten daher spezialisierten Zentren vorbehalten sein.60G. B. Frisoni et al.: Revised criteria for Alzheimer’s disease: what are the lessons for clinicians? In: The Lancet. Neurology. Band 10, Nr. 7, Juli 2011, S. 598–601, doi:10.1016/S1474-4422(11)70126-0. PMID 21683925. In den aktualisierten Leitlinien werden drei ineinander übergehende Stadien unterschieden:
- Das präklinische Stadium des Morbus Alzheimer,61R. A. Sperling et al.: Toward defining the preclinical stages of Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. In: Alzheimer’s & dementia. Band 7, Nr. 3, Mai 2011, S. 280–292, doi:10.1016/j.jalz.2011.03.003. PMID 21514248. PMC 3220946 freier Volltext.
- das Stadium der leichten kognitiven Beeinträchtigung („Mild Cognitive Impairment“, MCI)62M. S. Albert et al.: The diagnosis of mild cognitive impairment due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. In: Alzheimer’s & dementia: the journal of the Alzheimer’s Association. Band 7, Nr. 3, Mai 2011, S. 270–279, doi:10.1016/j.jalz.2011.03.008. PMID 21514249. PMC 3312027 (freier Volltext). und
- das Stadium der Demenz als Folge der Alzheimer-Erkrankung.63G. M. McKhann et al.: The diagnosis of dementia due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. In: Alzheimer’s & dementia: the journal of the Alzheimer’s Association. Band 7, Nr. 3, Mai 2011, S. 263–269, doi:10.1016/j.jalz.2011.03.005. PMID 21514250. PMC 3312024 (freier Volltext).
Im klinischen Alltag ergibt sich die Verdachtsdiagnose auf einen Morbus Alzheimer durch spezielle Tests zur Beurteilung des Gedächtnisses, durch die sogenannte Fremdanamnese, den klinischen Verlauf und allgemein verfügbare bildgebende Verfahren wie Computertomographie oder Magnetresonanztomographie. Definitiv bestätigt werden kann die Diagnose jedoch erst nach dem Tod des Patienten, indem eine feingewebliche Untersuchung des Gehirns durchgeführt wird.70L. Mucke: Neuroscience: Alzheimer’s disease. In: Nature. Band 461, 2009, S. 895–897, PMID 19829367.
Der Diagnoseschlüssel ICD-10 unterscheidet zwischen G30.0 Alzheimer-Krankheit mit frühem Beginn und G30.1 Alzheimer-Krankheit mit spätem Beginn allein nach dem Alter beim Auftreten erkennbarer Symptome.
Die Alzheimer-Krankheit muss stets von anderen, ähnlichen psychischen und neurologischen Störungen abgegrenzt werden, etwa von
- normaler altersbedingter Vergesslichkeit
- Verweigerung oder Vermeidungsverhalten
- leichter kognitiver Störung des Alters (unter der Chiffre ICD-10 F06.7 Organische psychische Störungen eingeordnet)
- Depression bei älteren Menschen mit Denkhemmung (evtl. mit zusätzlichen kognitiven Störungen im Sinne einer Zweiterkrankung)
- Deprivationserscheinungen bzw. Hospitalismus und Regression in Altersheimen
- einfacher Aphasie
- einfachem Mutismus
- schwerem Autismus (Kanner-Syndrom) mit Mutismus
- schweren neurologischen Syndromen wie dem Apallischen Syndrom, dem Locked-in-Syndrom oder dem akinetischen Mutismus
- Gehirntumoren, Gehirnverletzungen, die zu einem organischen amnestischen Syndrom führten (ICD-10 F04)
- Störungen des Stoffwechsels (beispielsweise Unterzuckerung bei Diabetikern)
- Schlaganfall
- Normaldruckhydrozephalus
- Delirium
- Psychosen und Wahn (beispielsweise Schizophrenie, Manie oder psychotische Depression)
- anderen Formen von Demenz
- Sprachstörungen, Wortfindungsstörungen und totalem Verlust der Sprache.
Früh- und Mittelstadium
Bei den meisten Patienten führen Defizite beim Lernen und der Merkfähigkeit zur Diagnosestellung.71H. Förstl, A. Kurz: Clinical features of Alzheimer’s disease. In: European Archives of Psychiatry and Clinical Neuroscience. Band 249, Nr. 6, 1999, S. 288–290, PMID 10653284. Während im Langzeitgedächtnis gewohnte Tätigkeitsabläufe und emotionale Erlebnisse meist noch gut gegenwärtig sind, sind das Lernen und das Kurzzeitgedächtnis am stärksten eingeschränkt.72G. A. Carlesimo, M. Oscar-Berman: Memory deficits in Alzheimer’s patients: a comprehensive review. In: Neuropsychology Review. Band 3, Nr. 2, 1992, S. 119–169, PMID 1300219.73M. Jelicic, A. E. Bonebakker, B. Bonke: Implicit memory performance of patients with Alzheimer’s disease: a brief review. In: International psychogeriatrics / IPA. Band 7, Nr. 3, 1995, S. 385–392, PMID 8821346.
Das Sprachvermögen der Betroffenen ist insgesamt reduziert, was sich im Sprachfluss und durch ein vermindertes Vokabular äußert. Grundsätzlich sind sie aber in der Lage, ihre Gedanken und Ideen anderen Personen in geeigneter Weise mitzuteilen.74E. M. Frank: Effect of Alzheimer’s disease on communication function. In: Journal of the South Carolina Medical Association (1975). Band 90, Nr. 9, 1994, S. 417–423, PMID 7967534.75J. T. Becker, A. A. Overman: [The semantic memory deficit in Alzheimer’s disease]. In: Revista De Neurologia. Band 35, Nr. 8, 2002, S. 777–783, PMID 12402233.76J. R. Hodges, K. Patterson: Is semantic memory consistently impaired early in the course of Alzheimer’s disease? Neuroanatomical and diagnostic implications. In: Neuropsychologia. Band 33, Nr. 4, 1995, S. 441–459, PMID 7617154.
Die Feinmotorik zeigt bereits gewisse Unsicherheiten, die bei Tätigkeiten wie Schreiben, Malen oder Ankleiden erkennbar sind.77T. Benke: Two forms of apraxia in Alzheimer’s disease. In: Cortex; a Journal Devoted to the Study of the Nervous System and Behavior. Band 29, Nr. 4, 1993, S. 715–725, PMID 8124945. Beim Übergang der Erkrankung zum Mittelstadium sind einige Patienten noch in der Lage, selbstständig ihren Alltag zu gestalten, bei komplizierten oder komplexen Tätigkeiten sind sie jedoch bereits auf Unterstützung angewiesen.78H. Förstl, A. Kurz: Clinical features of Alzheimer’s disease. In: European Archives of Psychiatry and Clinical Neuroscience. Band 249, Nr. 6, 1999, S. 288–290, PMID 10653284. Ein typisches Symptom in dieser Phase sind Trippelschritte.
Fortgeschrittenes Stadium
Im fortgeschrittenen Stadium verlernen die Patienten altbekannte Fertigkeiten und erkennen nahestehende Personen und alltägliche Gegenstände nicht mehr wieder.79Liz Kumru: Getting Lost in Alzheimer’s. UNMC; abgerufen am 22. Juli 2007 unmc.edu (Memento vom 10. Mai 2001 im Internet Archive)80Tom Rickey: Road Skills Hint At “Motion Blindness” Of Alzheimer’s. University of Rochester Medical Center, 31. Januar 2002, abgerufen am 25. März 2016.
Auch bei Patienten, die vor der Erkrankung ein friedfertiges Wesen besessen haben, kann es für Außenstehende zu scheinbar unbegründeten Wut- und Gewaltausbrüchen kommen. Schuldgefühle und allgemein eine innere Selbstreflexion nehmen im weiteren Verlauf immer mehr ab, so wie viele menschliche Verhaltensmuster nur noch automatisiert abzulaufen scheinen.
Die Muskulatur baut kontinuierlich ab, was zu weiteren Sprachproblemen, Harn– bzw. Stuhlinkontinenz und einer immer weiter abnehmenden Mobilität bis hin zur Bettlägerigkeit führt. Ohne Unterstützung können die Betroffenen ihren Alltag nicht mehr meistern und brauchen auch bei einfachen Tätigkeiten Unterstützung. Die Krankheit schreitet bis zum Tode voran, der bei den stark geschwächten Patienten oft durch eine Lungenentzündung oder einen Herzinfarkt ausgelöst wird.
Prognose
Nachdem die Diagnose Alzheimer gestellt worden ist, beträgt die verbleibende Lebenserwartung in etwa sieben bis zehn Jahre, wobei es auch Fälle gibt, in denen das Endstadium bereits nach vier bis fünf Jahren erreicht ist. Auf der anderen Seite gab es Patienten, die noch über 20 Jahre gelebt haben.
Verhinderung der Krankheit
Forschung an zukünftigen Impfstoffen
An einer Impfung, die der Krankheit vorbeugen oder zumindest das Fortschreiten der Krankheit verhindern können soll, wird vielfach geforscht.81Konzepte für Alzheimer-Impfungen im Testlabor. In: Deutsches Ärzteblatt. 9. November 2017, abgerufen am 9. August 2019.
So wird eine Beta-Amyloid-Immuntherapie auf Basis des monoklonalen Antikörpers Bapineuzumab bereits in klinischen Studien untersucht.82Antikörper löst Amyloid bei Alzheimer-Patienten.Ärzte Zeitung, 21. Mai 2010, abgerufen am 6. November 2010. Die US-Firmen Johnson & Johnson und Pfizer haben im August 2012 jedoch bekannt gegeben, dass sie die klinische Entwicklung von Bapineuzumab einstellen. Der monoklonale Antikörper, der die Beta-Amyloide aus dem Gehirn der Demenz-Patienten entfernen sollte, hat auch in einer zweiten Phase-III-Studie die Erwartungen nicht erfüllt.83rme/aerzteblatt.de: Alzheimer: Zweite Studie zur Antikörpertherapie abgebrochen. In: aerzteblatt.de. 7. August 2012, abgerufen am 27. Dezember 2014.
Eine Göttinger Forschergruppe wies nach, dass eine Impfung mit dem neuen monoklonalen Antikörper (9D5) bei Mäusen das Fortschreiten der Krankheit verhindert. Dieser Antikörper richtet sich gegen eine bestimmte Molekülstruktur im Gehirn und hindert sie daran, das Eiweiß Pyroglutamat-Abeta zu produzieren. Dieses Eiweiß bildet giftige Verklumpungen (Oligomere), die sich in den Nervenzellen und Blutgefäßen des Gehirns von Alzheimer-Erkrankten ansammeln und so die krankheitsauslösenden Schädigungen hervorrufen. Eine Anwendung beim Menschen ist Gegenstand weiterer Untersuchungen.84Oliver Wirths et al.: Identification of low molecular weight pyroglutamate A{beta} oligomers in Alzheimer disease: a novel tool for therapy and diagnosis. In: The Journal of Biological Chemistry. Band 285, Nr. 53, 2010, S. 41517–41524, doi:10.1074/jbc.M110.178707, PMID 20971852, PMC 3009878 (freier Volltext)..85Stefan Weller: Therapie gegen Alzheimer: Göttinger Forscher entwickeln neuen Ansatz für passive Immunisierung. Universitätsmedizin Göttingen – Georg-August-Universität, Pressemitteilung vom 5. November 2010 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 6. November 2010.
Blutdruck, Bewegung, Ernährung und Umwelteinflüsse
Verschiedene vorbeugende Maßnahmen gegen typische Zivilisationskrankheiten scheinen auch die Wahrscheinlichkeit zu senken, an Alzheimer zu erkranken. Die Datenlage und wissenschaftliche Akzeptanz von verschiedenen Nahrungsergänzungsmitteln, Verhaltensrichtlinien, Ernährungsvorschlägen, Umwelteinflüssen und Ersterkrankungen als Auslöser der Krankheit ist unterschiedlich.86Gary W. Small: What we need to know about age related memory loss. In: British Medical Journal. 22. Juni 2002, abgerufen am 5. November 2006. Dabei ist wichtig, dass Maßnahmen, die in der Lage sind, das Auftreten der Erkrankung zu verhindern, nicht unbedingt geeignet sind, den Verlauf einer bereits diagnostizierten Alzheimer-Krankheit günstig zu beeinflussen. Es gibt viele beobachtende Studien, jedoch nur wenige kontrolliert-randomisierte, welche die Wirksamkeit der Maßnahmen belegen. Bis 2006 wurde nach diesen strengen Studienkriterien nur für die Kontrolle des Blutdrucks eine signifikante Senkung des Alzheimer-Risikos festgestellt. Genauso fehlen bis heute aber auch nachweislich vorbeugende Arzneimittel.87M. Z. Scalco, R. van Reekum: Prevention of Alzheimer disease. Encouraging evidence. In: Canadian family physician Médecin de famille canadien. Band 52, Februar 2006, S. 200–207, PMID 16529393. PMC 1479722 (freier Volltext). (Review).
Ausreichende Bewegung,88Sam Norton et al.: Potential for primary prevention of Alzheimer’s disease: an analysis of population-based data. In: The Lancet Neurology. Band 13, Nr. 8, 2014, S. 788–794, doi:10.1016/S1474-4422(14)70136-X (Online).89K. A. Ginis et al.: Formulation of evidence-based messages to promote the use of physical activity to prevent and manage Alzheimer’s disease. In: BMC Public Health. Band 17, Nr. 1, Februar 2017, S. 209, doi:10.1186/s12889-017-4090-5, PMID 28212648, PMC 5316179 (freier Volltext). gesunde Ernährung mit einem hohen Anteil sekundärer Pflanzenstoffe wie dem Antioxidans Quercetin,90Äpfel fürs Hirn. Auf: wissenschaft.de vom 19. November 2004. ungesättigter Fettsäuren,91Mit Fischöl gegen das Vergessen. Auf: wissenschaft.de vom 2. September 2004. B-Vitamine92M. Morris, J. Schneider, C. Tangney: Thoughts on B-vitamins and dementia. In: J Alzheimers Dis. Band 9, Nr. 4, 2006, S. 429–433, PMID 16917152. – insbesondere Folsäure93Inna I. Kruman et al.: Folic Acid Deficiency and Homocysteine Impair DNA Repair in Hippocampal Neurons and Sensitize Them to Amyloid Toxicity in Experimental Models of Alzheimer’s Disease. In: The Journal of Neuroscience. Band 22, Nr. 5, 1. März 2002, PMID 11880504. Einen vereinfachten Bericht findet man hier: www.alzheimers.org.uk94Folate May Lower Alzheimer’s Risk In: CBS news, reporting from WebMD.95NIH Press Release: Folic Acid Possibly A Key Factor In Alzheimer’s Disease Prevention. (Nicht mehr online verfügbar.) In: nih.gov. 3. Januar 2002, archiviert vom Original am 24. Juni 2014; abgerufen am 29. Dezember 2019.96Kathleen Fackelmann: USATODAY.com – Folate shows promise in preventing Alzheimer’s. In: usatoday.com. 14. August 2005, abgerufen am 27. Dezember 2014. – sowie der Verzicht auf Nikotin97Raucher-Ausrede widerlegt. Auf: wissenschaft.de vom 8. Februar 2005. könnten sich positiv auswirken. Die Vitamine Folsäure, B6 und B12 bauen die toxische Aminosäure Homocystein zu ungefährlichen Substanzen ab. Wissenschaftliche Studien belegen, dass Homocystein ein entscheidender Mitauslöser der Arteriosklerose ist und das Gehirn verstärkt altern lässt: Menschen mit hohen Homocystein-Werten haben ein doppelt so hohes Risiko, an Alzheimer zu erkranken.98D. E. Zylberstein et al.: Midlife homocysteine and late-life dementia in women. A prospective population study. In: Neurobiology of aging. Band 32, Nr. 3, März 2011, S. 380–386, doi:10.1016/j.neurobiolaging.2009.02.024. PMID 19342123. Außerdem geht ein niedriger Vitamin-B12-Spiegel mit einer größeren Hirnatrophierate einher. Die Atrophierate des Gehirns von Patienten mit leichter kognitiver Beeinträchtigung lässt sich allerdings durch eine Behandlung mit Folsäure, Vitamin B12 und B6 um 29,6 Prozent senken.99A. D. Smith et al.: Homocysteine-lowering by B vitamins slows the rate of accelerated brain atrophy in mild cognitive impairment: a randomized controlled trial. In: PloS one. Band 5, Nr. 9, 2010, S. e12244, doi:10.1371/journal.pone.0012244. PMID 20838622. PMC 2935890 (freier Volltext).
In der Folgestudie von Januar 2013100G. Douaud et al.: Preventing Alzheimer’s disease-related gray matter atrophy by B-vitamin treatment. In: Proceedings of the National Academy of Sciences. Band 110, Nr. 23, Juni 2013, S. 9523–9528, doi:10.1073/pnas.1301816110. PMID 23690582. PMC 3677457 (freier Volltext). fanden die Wissenschaftler der Universität Oxford heraus, dass durch die externe Zufuhr von hochdosiertem Vitamin B12 in Verbindung mit Folsäure die Verringerung des Hirnvolumens bei Personen mit erhöhtem Alzheimer-Risiko im Vergleich zur Kontrollgruppe über den Zeitraum von zwei Jahren signifikant verlangsamt werden konnte.101Die Wunderwaffe gegen Alzheimer. In: vitamin-b12-mangel.org. Juli 2013, abgerufen am 27. Dezember 2014.David Smith, emeritierter Professor für Pharmakologie an der Universität Oxford, der die Studie leitete, sagte: “Es ist eine große Wirkung, viel größer, als wir zu träumen gewagt hatten.”102Andrea Gerlin: Vitamins That Cost Pennies a Day Seen Delaying Dementia – Businessweek. In: businessweek.com. 20. Mai 2013, abgerufen am 27. Dezember 2014. Mentale Aktivität103Education May Not Protect Against Dementia as Previously Thought. Rush University, 6. Februar 2019, abgerufen am 9. August 2019 (englisch). scheint ebenso günstig zu sein wie geistig anspruchsvolle Tätigkeiten.104Roy Eccleston: Think or sink. (PDF) (Nicht mehr online verfügbar.) In: The Weekend Australian Magazine. 2. Dezember 2006, archiviert vom Original am 23. Juli 2008; abgerufen am 3. Januar 2009.105Kreuzworträtsel lösen reicht nicht. (Nicht mehr online verfügbar.) In: GesundheitPro.de. 8. November 2007, archiviert vom Original am 10. Juli 2009; abgerufen am 3. Januar 2009.Bluthochdruck106Blutdruck senkende Mittel können Demenz vorbeugen. wissenschaft.de, 14. Oktober 2002. sollte möglichst früh erkannt und gut behandelt werden, um das Risiko einer Demenz zu senken. Wissenschaftliche Untersuchungen (Beyreuther et al.) haben ergeben, dass ein erhöhter Cholesterinspiegel das Risiko, an Alzheimer zu erkranken, erhöht.107A. Brüning: Wie Cholesterin das Risiko für Alzheimer erhöht. In: Berliner Zeitung, 11. Oktober 2005.Laut Berliner Zeitung soll es Hinweise darauf geben, dass Koffein (Kaffee, Tee usw.) schützend gegen die Entstehung der Alzheimer-Demenz wirkt.108Berliner Zeitung, 24. Oktober 2013, S. 12.
Antioxidantien, grüner und schwarzer Tee
In-vitro-Untersuchungen zeigten, dass das Antioxidans Epigallocatechingallat (EGCG) des grünen Tees die Bildung von Plaques verhindern kann.109J. P. Guo, S. Yu, PL. McGeer: Simple in vitro assays to identify amyloid-beta aggregation blockers for Alzheimer’s disease therapy. In: J Alzheimers Dis. Band 19, Nr. 4, 2010, S. 1359–1370, PMID 20061605.110S, Abbas, M. Mink: Epigallocatechin gallate inhibits beta amyloid oligomerization in Caenorhabditis elegans and affects the daf-2/insulin-like signaling pathway. In: J Alzheimers Dis. Band 17, Nr. 11, 2010, S. 902–909, PMID 20382008. Andere Studien weisen darauf hin, dass EGCG die Plaques auch auflösen kann.111D. E. Ehrnhoefer et al.: EGCG redirects amyloidogenic polypeptides into unstructured, off-pathway oligomers. In: Nat Struct Mol Biol. Band 15, Nr. 5, Juni 2008, S. 558–566, PMID 18511942.112J. Bieschke et al.: EGCG remodels mature α-synuclein and amyloid-β fibrils and reduces cellular toxicity. In: Proc Natl Acad Sci USA. Band 107, Nr. 17, April 2010, PMID 20385841.113F. Meng et al.: The flavanol (–)-epigallocatechin 3-gallate inhibits amyloid formation by islet amyloid polypeptide, disaggregates amyloid fibrils, and protects cultured cells against IAPP-induced toxicity. In: Biochemistry. Band 49, Nr. 37, September 2010, PMID 20707388. In Tierversuchen mit Mäusen konnte gezeigt werden, dass nach sechsmonatiger EGCG-Behandlung die Plaque-Belastung im Kortex, Hippocampus und im entorhinalen Kortex um jeweils 54 %, 43 % und 58 % reduziert wurde.114K. Rezai-Zadeh et al.: Green tea epigallocatechin-3-gallate (EGCG) reduces beta-amyloid mediated cognitive impairment and modulates tau pathology in Alzheimer transgenic mice. In: Brain Res. Band 12, Nr. 1214, Juni 2008, S. 177–186, PMID 18457818. Eine weitere Studie, die die Auswirkung von EGCG auf die Alzheimer-Krankheit untersucht, wird an der Charité in Berlin durchgeführt.115„Wie greift EGCG in den Mechanismus der Amyoidbildung ein?“ Untersuchungen aus dem Jahr 2011 konnten zeigen, dass Theaflavinbestandteile des Schwarzen Tees ebenfalls die Entstehung von Plaques verhindern und bestehende Plaques auflösen können.116G. Grelle et al.: Black Tea Theaflavins Inhibit Formation of Toxic Amyloid-β and α-Synuclein Fibrils. In: Biochemistry. November 2011, PMID 22054421.
Medizinische Behandlung der erkrankten Menschen
Die Alzheimer-Krankheit kann derzeit nicht geheilt werden. Die positive Wirkung der derzeit zur Demenzbehandlung zugelassenen Medikamente auf bestehende Symptome ist nur relativ gering, sie können das Voranschreiten der Erkrankung nicht stoppen. Im Jahre 2006 wurde von der Amerikanischen Vereinigung für Geriatrische Psychiatrie ein Konsenspapier zur Alzheimer-Behandlung veröffentlicht. Nach einer präklinischen Studie der Case Western Reserve University vom Februar 2012117P. E. Cramer et al.: ApoE-directed therapeutics rapidly clear β-amyloid and reverse deficits in AD mouse models. In: Science. Band 335, Nr. 6075, März 2012, S. 1503–1506, doi:10.1126/science.1217697. PMID 22323736. PMC 3651582 (freier Volltext). konnte das Chemotherapeutikum Bexaroten bei Mäusen bis zu 75 % der β-Amyloid-Plaques auflösen und auch Symptome der Krankheit, wie den Gedächtnisverlust, revidieren.118Jessica Studeny: Drug quickly reverses Alzheimer’s symptoms in mice. Veröffentlichung der Case Western Reserve University, 9. Februar 2012.119Drug Quickly Reverses Alzheimer’s Symptoms in Mice. Meldung bei Neurosciencenews.com vom 10. Februar 2012.120Harald Frater: Krebsmedikament macht Alzheimer-Symptome rückgängig: Wirkstoff Bexaroten beseitigt Gedächtnisstörungen und Eiweiß-Plaques bei Mäusen. In: g-o.de. 10. Februar 2012, abgerufen am 27. Dezember 2014. Nachfolgende präklinische Versuche anderer Forschungsgruppen konnten die vielversprechenden Ergebnisse nicht bestätigen.121E. O’Hare et al.: Lack of support for bexarotene as a treatment for Alzheimer’s disease. In: Neuropharmacology. [elektronische Veröffentlichung vor dem Druck] Mai 2015, doi:10.1016/j.neuropharm.2015.04.020, PMID 26025659.122C. Balducci et al.: The Continuing Failure of Bexarotene in Alzheimer’s Disease Mice. In: Journal of Alzheimer’s disease: JAD. [elektronische Veröffentlichung vor dem Druck] März 2015, doi:10.3233/JAD-150029, PMID 25777514.123B. Tousi: The emerging role of bexarotene in the treatment of Alzheimer’s disease: current evidence. In: Neuropsychiatric disease and treatment. Band 11, 2015, S. 311–315, doi:10.2147/NDT.S61309, PMID 25709453, PMC 4327563 (freier Volltext) (Review). Bexaroten ist nicht zur Behandlung der Alzheimer-Krankheit zugelassen.
Acetylcholinesterase-Hemmer
Die Medikamente sorgen dafür, dass Acetylcholin im Gehirn langsamer abgebaut wird und damit in höherer Konzentration vorliegt. Dadurch soll der Verringerung des Acetylcholin-Niveaus durch das Absterben von Neuronen, die diesen Botenstoff produzieren, entgegengewirkt werden. Acetylcholin ist ein vielfach im Assoziationscortex auftretender Neurotransmitter, der efferente Nervenverbindungen zum Hippocampus (für die in Alzheimer-Patienten geschädigte Gedächtnisbildung verantwortlich) aussendet. So erklärt sich, dass der Hippocampus zwar selbst nicht cholinerg ist, die Therapie mit Acetylcholinesterase-Hemmern aber dennoch seine Aktivität ankurbelt.124Weblink für Paper Paul T. Francis, Gordon K. Wilcock et al.: The cholinergic hypothesis of Alzheimer’s disease: a review of progress In: J Neurol Neurosurg Psychiatry (1999) Vertreter dieser Wirkstoffgruppe sind Galantamin, Donepezil, Rivastigmin sowie der Wirkstoff Huperzin A, der derzeit (Stand 2018) klinisch erforscht wird.125Huperzine A Alzheimer Research Forum126B. S. Wang, H. Wang, Z. H. Wei, Y. Y. Song, L. Zhang, H. Z. Chen: Efficacy and safety of natural acetylcholinesterase inhibitor huperzine A in the treatment of Alzheimer’s disease: an updated meta-analysis. In: Journal of Neural Transmission. Band 116, Nr. 4, 2009, S. 457–465, doi:10.1007/s00702-009-0189-x, PMID 19221692. Zugelassen sind die Acetylcholinesterase-Hemmer bei leichter bis mittelschwerer Alzheimer-Demenz, nicht bei schwerer. Die Wirksamkeit der Therapie wird diskutiert. In der Ideal-Studie wird gezeigt, dass sowohl die Pflaster-Applikation als auch die orale Gabe von Rivastigmin die kognitiven Fähigkeiten der Patienten deutlich gegenüber Placebo verbessern.127B. Winblad, J. Cummings, N. Andreasen et al.: A six-month double-blind, randomized, placebo-controlled study of a transdermal patch in Alzheimer’s disease – rivastigmine patch versus capsule. In: International Journal of Geriatric Psychiatry, Band 22, Nr. 5, S. 456–467, May 2007 doi:10.1002/gps.1788 PMID 17380489 Es gibt aber auch Studien, die eine geringe Wirkung der Acetylcholinesterase-Hemmer zeigen.128H. Kaduszkiewicz, T. Zimmermann, H. P. Beck-Bornholdt, Hendrik van den Bussche: Cholinesterase inhibitors for patients with Alzheimer’s disease: systematic review of randomised clinical trials. In: BMJ (Clinical Research Ed.). Band 331, Nr. 7512, August 2005, S. 321–327, PMID 16081444, PMC 1183129 (freier Volltext). Unter deutschen Psychiatern ist das Ausmaß des Nutzens der Präparate daher umstritten.129T. Lempert, T. Bschor: [Treatment of Alzheimer’s disease according to the S3 guidelines on dementia. Choline esterase inhibitors for all and for ever?]. In: Der Nervenarzt. Band 82, Nr. 1, Januar 2011, S. 90–91, doi:10.1007/s00115-010-3233-z. PMID 21274696.
Ibuprofen und andere nichtsteroidale Entzündungshemmer
In retrospektiven Studien wurde bereits 1995 festgestellt,130J. C. Breitner, K. A. Welsh et al.: Delayed onset of Alzheimer’s disease with nonsteroidal anti-inflammatory and histamine H2 blocking drugs. In: Neurobiology of Aging Volume 16, Issue 4, Pages 523-530, July 1995 PMID 8544901 dass Rheumapatienten ein signifikant reduziertes Risiko haben, die Alzheimer-Krankheit zu entwickeln, beziehungsweise dass die Krankheit bei ihnen später als bei Nichtrheumatikern ausbricht. Daraus wurde geschlossen, dass dieser Effekt auf die nichtsteroidalen Antirheumatika (NSAR) (in englischsprachigen Publikationen nonsteroidal anti-inflammatory drugs (NSAID) genannt) zurückzuführen ist, die diese Patienten einnehmen.131T. Wyss-Coray, L. Mucke: Ibuprofen, inflammation and Alzheimer disease. In: Nature medicine. Band 6, Nr. 9, September 2000, S. 973–974, doi:10.1038/79661. PMID 10973311.132D. Dokmeci: Ibuprofen and Alzheimer’s disease. In: Folia medica. Band 46, Nr. 2, 2004, S. 5–10, PMID 15506544. (Review).
In einigen transgenen Tiermodellen konnte eine Reduktion von Beta-Amyloid-Plaques bei der Gabe von Ibuprofen festgestellt werden.133T. Morihara et al.: Ibuprofen suppresses interleukin-1beta induction of pro-amyloidogenic alpha1-antichymotrypsin to ameliorate beta-amyloid (Abeta) pathology in Alzheimer’s models. In: Neuropsychopharmacology: official publication of the American College of Neuropsychopharmacology. Band 30, Nr. 6, Juni 2005, S. 1111–1120, doi:10.1038/sj.npp.1300668. PMID 15688088.134A. C. McKee et al.: Ibuprofen reduces Abeta, hyperphosphorylated tau and memory deficits in Alzheimer mice. In: Brain research. Band 1207, Mai 2008, S. 225–236, doi:10.1016/j.brainres.2008.01.095. PMID 18374906. PMC 2587244 (freier Volltext).135M. Sastre et al.: Nonsteroidal anti-inflammatory drugs repress beta-secretase gene promoter activity by the activation of PPARgamma. In: Proceedings of the National Academy of Sciences. Band 103, Nr. 2, Januar 2006, S. 443–448, doi:10.1073/pnas.0503839103. PMID 16407166. PMC 1326151 (freier Volltext)./mfn] Beim Menschen liegen bisher keine Daten aus randomisierten Doppelblind-Studien vor, die eine gesicherte Wirkungsweise von Ibuprofen und anderen nichtsteroidalen Antirheumatika aufzeigen. Aufgrund der nicht unerheblichen Nebenwirkungen, die bei einer dauerhaften prophylaktischen Einnahme von Ibuprofen zu erwarten sind, wird von einer unkontrollierten Einnahme abgeraten.135N. Tabet, H. Feldmand: Ibuprofen for Alzheimer’s disease. In: The Cochrane database of systematic reviews. Nr. 2, 2003, S. CD004031, doi:10.1002/14651858.CD004031. PMID 12804498. (Review).136B. De Strooper, G. König: An inflammatory drug prospect. In: Nature. Band 414, Nr. 6860, November 2001, S. 159–160, doi:10.1038/35102656. PMID 11700538. Die zur möglichen Prävention der Alzheimer-Krankheit notwendigen Dosen an nichtsteroidalen Antirheumatika sind erheblich höher als zur normalen Schmerzbehandlung. Die nichtsteroidalen Antirheumatika stehen in Verdacht, kardiovaskuläre Probleme hervorzurufen, wenn sie auf Dauer und in hohen Dosen eingenommen werden.137Gregor Larbig: Studien zur Identifizierung & Optimierung potentieller Wirkstoffe für die Behandlung von Morbus Alzheimer. Dissertation, TU Darmstadt, 2007
Mit Ibuprofen und Derivaten von Ibuprofen laufen zurzeit eine Reihe klinischer Studien bei Alzheimer-Patienten.138T. Müller: Neue Wege gegen das Amyloid im Hirn. In: Ärzte Zeitung am 7. Dezember 2007
Aktivierung von ABC-Transportern
Am Mausmodell konnte gezeigt werden, dass durch die Nutzung von Thiethylperazin und Thiethylperazin-Derivaten mit ABC-Transporter aktivierender Wirkung eine Behandlung von neurodegenerativen Erkrankungen sowie die Funktion des Transporters ABCC1 zur Diagnostik und Therapieüberwachung von Morbus Alzheimer (und Morbus Parkinson) möglich ist. Durch diese Wirkstoffe könnte der Verlauf der Alzheimer-Demenz und des Morbus Parkinson um mehrere Jahre verzögert werden.139M. Krohn et al.: Cerebral amyloid-β proteostasis is regulated by the membrane transport protein ABCC1 in mice. In: The Journal of clinical investigation. Band 121, Nr. 10, Oktober 2011, S. 3924–3931, doi:10.1172/JCI57867. PMID 21881209. PMC 3195473 (freier Volltext). Das Medikament befindet sich in der klinischen Phase II unter EudraCT Number: 2014-000870-20.
NMDA-Rezeptor-Antagonist
Die Beeinflussung des Botenstoffes Glutamat, des häufigsten erregenden Botenstoffs im zentralen Nervensystem, der an Lernprozessen und Gedächtnisfunktionen beteiligt ist, wurde europaweit 2002 und in den USA 2003 zugelassen. Der bisher einzige Vertreter dieser Wirkstoffklasse ist Memantin. Dies ist ein NMDA-Rezeptor–Antagonist (N-Methyl-D-Aspartat-Rezeptor-Antagonist) und soll die bei Alzheimer-Demenzen verstärkte glutamaterge Signalweiterleitung normalisieren. Studienergebnisse zeigen, dass Memantin bei mittlerer bis schwerer Erkrankung nach sechs Monaten zu einer insgesamt geringfügigen Verbesserung der kognitiven Störungen und der beeinträchtigten Alltagsaktivitäten führt.140R. McShane, A. Areosa Sastre, N. Minakaran: Memantine for dementia. In: The Cochrane database of systematic reviews. Nr. 2, 2006, S. CD003154, doi:10.1002/14651858.CD003154.pub5. PMID 16625572. (Review). Zugelassen ist Memantin bei moderater bis schwerer Alzheimer-Demenz, nicht bei leichter.
Ginkgo biloba
Der Spezialextrakt EGb 761 ist zugelassen zur symptomatischen Behandlung von „hirnorganisch bedingten geistigen Leistungseinbußen bei demenziellen Syndromen“. Als Standarddosis gelten 240 Milligramm täglich. Außer diesem Extrakt gibt es noch eine Vielzahl von anderen Ginkgo-biloba-haltigen Präparaten, die sich in ihrer exakten Zusammensetzung unterscheiden. Eine Meta-Analyse der vorliegenden Studienergebnisse aus dem Jahre 2007 kam zu dem Schluss, dass die Hinweise auf einen günstigen Einfluss von Ginkgo-Präparaten auf die kognitiven Fähigkeiten von Alzheimer-Patienten unschlüssig und wenig überzeugend seien;141J. Birks, Evans J. Grimley: Ginkgo biloba for cognitive impairment and dementia. In: Cochrane Database Syst Rev. Nr. 2, 2007, S. CD003120, doi:10.1002/14651858.CD003120.pub2, PMID 17443523 in einer vorangegangenen Publikation hatten dieselben Autoren Ginkgo als vielversprechend beschrieben.142J. Birks, E. Grimley, M. Van Dongen: Ginkgo biloba for cognitive impairment and dementia. In: Cochrane Database Syst Rev. S. CD003120, PMID 12519586.
In den USA wurde eine große doppeltblinde Langzeitstudie (GEM-Studie) durchgeführt, die klären sollte, ob Ginkgo effektiv zur Prävention von Alzheimer eingesetzt werden kann.143S. T. DeKosky, A. Fitzpatrick, D. G. Ives, J. Saxton, J. Williamson, O. L. Lopez, G. Burke, L. Fried, L. H. Kuller, J. Robbins, R. Tracy, N. Woolard, L. Dunn, R. Kronmal, R. Nahin, C. Furberg: The Ginkgo Evaluation of Memory (GEM) study: design and baseline data of a randomized trial of Ginkgo biloba extract in prevention of dementia. In: Contemp Clin Trials. Band 27, Nr. 3, 2006, S. 238–253, doi:10.1016/j.cct.2006.02.007, PMID 16627007. Die im Jahre 2008 veröffentlichten Resultate ergaben keinen signifikanten Unterschied zwischen dem Ginkgo-Präparat (2× täglich 120 mg) und Placebo – während in der Placebo-Gruppe 246 Personen eine Demenz entwickelten, waren es in der Ginkgo-Gruppe 277 Personen.144Ginkgo Biloba Does Not Reduce Dementia Risk, Study Shows. In: sciencedaily.com. 19. November 2008, abgerufen am 27. Dezember 2014. Eine weitere Analyse der GEM-Studie, Ende 2009 publiziert, ergab zudem, dass der Spezialextrakt bei den durchschnittlich knapp 80-jährigen Patienten einen mentalen Leistungsverlust nicht aufhalten konnte.145B. E. Snitz et al.: Ginkgo biloba for preventing cognitive decline in older adults: a randomized trial. In: JAMA. Band 302, Nr. 24, Dezember 2009, S. 2663–2670, doi:10.1001/jama.2009.1913. PMID 20040554. PMC 2832285 (freier Volltext). Die Autoren der Studie weisen in ihrer Diskussion der Ergebnisse zum einen darauf hin, dass die verwendeten kognitiven Tests möglicherweise nicht geeignet waren, um Effekte des Präparats erkennen zu können. Zum anderen sollen die Studienteilnehmer ungewöhnlich gesund und gebildet gewesen sein, was das Auftreten kognitiver Leistungsschwächen relativ unwahrscheinlich mache. Eine Literaturanalyse von Wissenschaftlern der Charité kam 2010 zu dem Schluss, dass der Spezialextrakt zwar wirksamer sei als Placebo, der Effekt jedoch moderat ausfalle und die klinische Bedeutung dieses Effektes wie generell bei Antidementiva sehr schwer zu bestimmen sei.146Stefan Weinmann et al.: Effects of Ginkgo biloba in dementia: systematic review and meta-analysis. In: BMC Geriatrics 2010, 10:14 doi:10.1186/1471-2318-10-14
Das deutsche Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen untersuchte 2008 im Rahmen einer Arzneimittelbewertung öffentlich zugängliche Studien sowie von Arzneimittelherstellern zur Verfügung gestellte Daten der in Deutschland verfügbaren ginkgohaltigen Präparate. Es kam zu dem Schluss, dass es einen Beleg für einen Nutzen beim Therapieziel „Aktivitäten des täglichen Lebens“ gebe, sofern 240 mg Extrakt täglich eingenommen werden. Für die Therapieziele „kognitive Fähigkeiten“ und „allgemeine psychopathologische Symptome“ sowie für das angehörigenrelevante Therapieziel „Lebensqualität der (betreuenden) Angehörigen“ (gemessen am emotionalen Stress der Angehörigen) gebe es bei derselben Dosierung nur einen Hinweis auf einen Nutzen.147Abschlussbericht „Ginkgohaltige Präparate bei Alzheimer Demenz“. (PDF) Institut für Qualität und Wirtschaftlichkeit im Gesundheitswesen, 21. November 2008.
Weitere Studien deuten darauf hin, dass Ginkgo-Blätter pharmakologisch wirksamere Substanzen enthalten, die möglicherweise eine ursächliche Behandlung der präklinischen Alzheimer-Demenz zulassen.148B. Kastenholz: Phytopharmaceuticals in the therapy of younger Alzheimer patients. WebmedCentral AGING 2011; 2 (7): WMC002011.
Cannabis
Eine systematische Übersichtsarbeit, veröffentlicht 2009 von der Cochrane Collaboration, kam zu dem Ergebnis, dass es keine Nachweise dafür gebe, dass Cannabinoide eine Wirkung zur Vermeidung oder Besserung von Symptomen der Alzheimer-Krankheit haben.149S. Krishnan, R. Cairns, R. Howard: Cannabinoids for the treatment of dementia. In: The Cochrane database of systematic reviews. Nr. 2, 2009, S. CD007204, doi:10.1002/14651858.CD007204.pub2, PMID 19370677 (Review). Der damalige Stand hat sich seitdem nicht geändert (Stand Januar 2016).
Insulin
Beachtenswert ist der Effekt, dass Insulin, verabreicht als Nasenspray (vermutlich durch direkten Kontakt mit dem Zentralnervensystem), den Verlauf der Alzheimer-Krankheit positiv beeinflussen kann.150S. Craft et al.: Intranasal insulin therapy for Alzheimer disease and amnestic mild cognitive impairment: a pilot clinical trial. In: Archives of neurology. Band 69, Nr. 1, Januar 2012, S. 29–38, doi:10.1001/archneurol.2011.233. PMID 21911655. PMC 3260944 (freier Volltext).
Vitamine und Nahrungsergänzungsmittel
Eine neue randomisierte klinische Studie zeigt, dass Vitamin E in hoher Dosierung den Fortschritt der Pflegebedürftigkeit leicht verzögern kann.151M. W. Dysken et al.: Effect of vitamin E and memantine on functional decline in Alzheimer disease: the TEAM-AD VA cooperative randomized trial. In: JAMA. Band 311, Nr. 1, Januar 2014, S. 33–44, doi:10.1001/jama.2013.282834. PMID 24381967. PMC 4109898 (freier Volltext). Im Gegensatz dazu hat das Antidementivum Memantin in dieser Studie enttäuscht. Primärer Endpunkt war der ADCS-ADL (Alzheimer’s Disease Cooperative Study – Activities of Daily Living), welcher alltagspraktische Fertigkeiten erfasst. Vitamin E konnte den Abfall des ADCS-ADL etwas verzögern, auch wenn die Signifikanz erst nach einer Adjustierung erreicht wurde. Zudem starben von 613 Teilnehmern 128 vor Abschluss der Studie. Die Studie reiht sich also in eine Serie Studien mit unterschiedlichen Aussagen zur Wirksamkeit von Vitamin E bei Morbus Alzheimer ein.152M. Sano et al.: A controlled trial of selegiline, alpha-tocopherol, or both as treatment for Alzheimer’s disease. The Alzheimer’s Disease Cooperative Study. In: The New England Journal of Medicine. Band 336, Nr. 17, April 1997, S. 1216–1222, doi:10.1056/NEJM199704243361704. PMID 9110909.153R. C. Petersen et al.: Vitamin E and donepezil for the treatment of mild cognitive impairment. In: The New England Journal of Medicine. Band 352, Nr. 23, Juni 2005, S. 2379–2388, doi:10.1056/NEJMoa050151. PMID 15829527.154J. H. Kang et al.: A randomized trial of vitamin E supplementation and cognitive function in women. In: Archives of internal medicine. Band 166, Nr. 22, 2006 Dec 11-25, S. 2462–2468, doi:10.1001/archinte.166.22.2462. PMID 17159011.155J. H. Kang et al.: Vitamin E, vitamin C, beta carotene, and cognitive function among women with or at risk of cardiovascular disease: The Women’s Antioxidant and Cardiovascular Study. In: Circulation. Band 119, Nr. 21, Juni 2009, S. 2772–2780, doi:10.1161/CIRCULATIONAHA.108.816900. PMID 19451353. PMC 2752297 (freier Volltext). Wegen des geringen Effekts und der möglichen erhöhten Mortalität156E. R. Miller et al.: Meta-analysis: high-dosage vitamin E supplementation may increase all-cause mortality. In: Annals of internal medicine. Band 142, Nr. 1, Januar 2005, S. 37–46, PMID 15537682. kann die hochdosierte Vitamin-E-Gabe also noch nicht generell empfohlen werden.
In einer zweijährigen europäischen Studie LipiDiDiet157Hilkka Soininen et al.: 24-month intervention with a specific multinutrient in people with prodromal Alzheimer’s disease (LipiDiDiet): a randomised, double-blind, controlled trial. In: The Lancet Neurology. Band 0, Nr. 0, ISSN 1474-4422, doi:10.1016/S1474-4422(17)30332-0 (Online ,abgerufen am 11. November 2017). an elf Kliniken mit 311 Patienten konnte 2017 nachgewiesen werden, dass sich mit dem kombinierten Zusatz der Omega-3-Fettsäuren Docosahexaensäure (DHA) und Eicosapentaensäure (EPA), verschiedener Vitamine (B12, B6, C, E und Folsäure) und anderer Nährstoffen wie Cholin, Uridinmonophosphat und Selen zur Nahrung von Erkrankten die kognitiven und funktionellen Leistungen im Alltag signifikant verbessert haben. Im Vergleich zur Kontrollgruppe beobachten die Forscher eine um 45 % geringere Verschlechterung der klinischen Einschätzung der Demenz. In der MRT-Bildgebung wurde im Hippocampus eine um 26 % geringere Schrumpfung bei den Patienten mit Nahrungsergänzungsmitteln im Vergleich zu Patienten der Kontrollgruppe verzeichnet.158Ärzte Zeitung: Europäische Studie: Hilft Nährstoff-Kombi bei Alzheimer im Frühstadium? Abgerufen am 11. November 2017.
Psychotherapeutische Behandlung
Symptome wie innere Unruhe, depressive Verstimmung oder Erregung und Aggressivität, die im Verlauf der Krankheit möglicherweise auftreten, können mit Hilfe von Psychotherapie und Psychopharmaka behandelt werden. Daneben werden seit Beginn des 21. Jahrhunderts zunehmend nichtpharmakologische Interventionen bei Verhaltensstörungen von Demenzkranken favorisiert.159J. Cohen-Mansfield: Nonpharmacologic interventions for inappropriate behaviors in dementia: a review, summary, and critique. In: Am J Geriatr Psychiatry. 9 (4), 2001, S. 361–381. PMID 11739063 (Review)
Verhaltensrichtlinien
Eine amerikanische Studie ergab, dass Personen, die zwischen ihrem 20. und 50. Lebensjahr eine geistig wenig anspruchsvolle Tätigkeit ausgeübt hatten, häufiger an Alzheimer erkranken. Möglicherweise wird die Schwelle, ab der Symptome erkennbar werden, herabgesetzt.160(BBC News August 2004)
Aktuelle wissenschaftliche Arbeiten lassen vermuten, dass bereits leichte, aber regelmäßige körperliche Aktivität (Spazierengehen, Gartenarbeit) vielleicht vor der Entwicklung einer Alzheimer-Demenz schützen.161L. E. Middleton et al.: Activity energy expenditure and incident cognitive impairment in older adults. In: Archives of internal medicine. Band 171, Nr. 14, Juli 2011, S. 1251–1257, doi:10.1001/archinternmed.2011.277. PMID 21771893. PMC 3923462 (freier Volltext). Es wird angenommen, dass die positiven Einflüsse der Bewegung auf vaskuläre Risikofaktoren (Bluthochdruck, Fettstoffwechselstörungen und Diabetes mellitus) vaskulär bedingte Schäden im Gehirn reduzieren und so – indirekt – das Auftreten von Demenz-Symptomen behindern.162M. N. Vercambre et al.: Physical activity and cognition in women with vascular conditions. In: Archives of internal medicine. Band 171, Nr. 14, Juli 2011, S. 1244–1250, doi:10.1001/archinternmed.2011.282. PMID 21771894. PMC 3153432 (freier Volltext).
Die Anpassung der Lebensräume an die veränderten Möglichkeiten und Bedürfnisse können den Alltag von Betroffenen und Pflegekräften erleichtern. Die Vereinfachung von Tätigkeitsabläufen und das Beschriften von Gegenständen helfen dem Patienten dabei, ein höheres Maß an Unabhängigkeit zu erhalten. Veränderungen der bekannten Abläufe oder der Umgebung regen die Patienten oft unnötig auf, während gut ausgeleuchtete Räume, angemessene Pausen und begrenzte Anforderungen dem Patienten ein sicheres Gefühl geben. Angemessene soziale und visuelle Stimulation kann zu einer Verbesserung der Aufmerksamkeit und Orientierung führen, beispielsweise kann eine Steigerung der Nahrungsaufnahme erreicht werden, wenn auffallend farbige Tisch-Accessoires verwendet werden, die Alzheimer-Patienten mit verminderter Kontrasterkennung besser wahrnehmen können.163T. E. Dunne, S. A. Neargarder, P. B. Cipolloni, A. Cronin-Golomb: Visual contrast enhances food and liquid intake in advanced Alzheimer’s disease. In: Clin Nutr. Band 23, Nr. 4, 2004, S. 533–538, PMID 15297089.
Beratung und Unterstützung im Alltag
Spezialisierte Pflegefachkräfte
Spezialisierte Pflegefachkräfte können zuhause oder im Heim spezifische Unterstützung im Alltag bieten.
Ergotherapie
Das Ziel der Ergotherapie ist die grösstmögliche Selbstständigkeit im Alltag. Auf Hausbesuchen können Ergotherapeutinnen und Ergotherapeuten Angehörige schulen und Empfehlungen zur Sturzprävention in der Wohnung abgeben.164S3-Leitlinie Demenzen. 2017, doi:10.1007/978-3-662-53875-3. Im Heim können Ergotherapeutinnen und Ergotherapeuten Betroffene darin unterstützen, bedeutungsvolle Betätigungen weiterhin auszuführen. In ergotherapeutischen Gruppentherapien können Betroffene kognitive Fähigkeiten trainieren.
Geschichte
Im November 1906 beschrieb der deutsche Psychiater und Neuropathologe Alois Alzheimer in einem Vortrag vor Kollegen den ersten Fall der Krankheit, die später als Alzheimer-Krankheit bekannt wurde. Er hatte die Patientin Auguste Deter bereits im November 1901 nach ihrer Aufnahme in die Frankfurter Nervenklinik kennengelernt. Er begleitete die damals 51 Jahre alte Patientin aufmerksam und protokollierte ihr Verhalten. Als Auguste Deter im April 1906 starb, war Alois Alzheimer mittlerweile Laborleiter bei Emil Kraepelin in München geworden. Da er an der Erforschung der Demenz interessiert war, ließ er sich das Gehirn der verstorbenen Patientin von Emil Sioli schicken und untersuchte es. Sein Vortrag im November 1906 löste keine Reaktionen aus. Im nächsten Jahr veröffentlichte er seine Erkenntnisse in dem Beitrag Über eine eigenartige Erkrankung der Hirnrinde in der Allgemeinen Zeitschrift für Psychiatrie.165A. Alzheimer: Über eine eigenartige Erkrankung der Hirnrinde. In: Allg. Z. Psychiat. Psych.-Gerichtl. Med. Band 64, Nr. 1–2, 1907, S. 146–148.166Konrad Maurer, Ulrike Maurer: Alzheimer: the life of a physician and the career of a disease. Columbia University Press, New York 2003.167Fred H. Hochberg, David Rottenberg: Neurological classics in modern translation. Hafner Press, New York 1977, ISBN 0-02-851180-8.
In den folgenden fünf Jahren wurden elf ähnliche Fälle in der medizinischen Literatur beschrieben; einige bereits unter Verwendung der Bezeichnung Alzheimer-Krankheit.168N. C. Berchtold, C. W. Cotman: Evolution in the conceptualization of dementia and Alzheimer’s disease: Greco-Roman period to the 1960s. In: Neurobiol. Aging. Band 19, Nr. 3, 1998, S. 173–189, PMID 9661992. Die offizielle Benennung geht auf den Psychiater Emil Kraepelin zurück. Er benannte die Erkrankung in der achten Ausgabe seines Lehrbuchs der Psychiatrie aus dem Jahre 1910 nach Alois Alzheimer.169Emil Kraepelin: Textbook of Psychiatry. 1910.
Da die von Alois Alzheimer betreute Patientin relativ jung war, beschrieb er die Erkrankung als präsenile Demenz. Erst später erkannte man, dass dieselben histologischen Veränderungen auch bei älteren Demenz-Patienten auftreten. Zur Abgrenzung gegenüber dem echten (präsenilen) Morbus Alzheimer bezeichnet man die Erkrankungsform des älteren Menschen als Senile Demenz vom Alzheimer-Typ (SDAT oder DVAT).
Im Jahr 1997 wurden originale Mikroskop-Präparate von Alois Alzheimers Arbeit in München wiederentdeckt und neu evaluiert.170M. B. Graeber et al.: Rediscovery of the case described by Alois Alzheimer in 1911: historical, histological and molecular genetic analysis. In: Neurogenetics. Band 1, Nr. 1, Mai 1997, S. 73–80, PMID 10735278. 2012 wurde in dem Material eine Präsenilin-Mutation nachgewiesen.171U. Müller, P. Winter, M. B. Graeber: A presenilin 1 mutation in the first case of Alzheimer’s disease. In: The Lancet. Neurology. Band 12, Nr. 2, Februar 2013, S. 129–130, doi:10.1016/S1474-4422(12)70307-1. PMID 23246540.
Gesellschaftliche Wahrnehmung
Prominente Alzheimer-Kranke
In den 1970er Jahren begann man, offener über Alterserkrankungen zu sprechen. 1976 erklärte Harold Wilson (1916–1995) seinen Rücktritt als englischer Premierminister, weil er gemerkt hatte, dass er an beginnendem Alzheimer litt. Dies wurde in den 1980er Jahren bekannt. Die Erkrankungen zum Beispiel von Rita Hayworth († 1987), dem Boxer Sugar Ray Robinson (1921–1989), dem Fußballer Helmut Schön (1915–1996), dem langjährigen Leiter der New Yorker Metropolitan Opera Rudolf Bing (1902–1997), Iris Murdoch (1919–1999),172Preisgekrönte Filmbiographie Iris von 2001. Darin wird die Geschichte ihres Verfalls aus der Sicht ihres Mannes John Bayley beschrieben. Murdoch wurde von Kate Winslet und Judi Dench dargestellt. Charles Bronson († 2003), Helmut Zacharias († 2002) und Peter Falk († 2011) machten bewusst, dass es jeden treffen kann. Ronald Reagan (1911–2004), US-Präsident von 1981 bis 1989, bekannte sich 1994 (mit 83 Jahren) in einem Brief an die amerikanische Öffentlichkeit zu seiner Alzheimer-Erkrankung: „Ich beginne nun die Reise, die mich zum Sonnenuntergang meines Lebens führt, in der Gewissheit, dass über Amerika immer wieder ein strahlender Morgen heraufdämmern wird.“
Nachdem der englische Fantasy-Autor Terry Pratchett († 12. März 2015) 2007 die Diagnose gestellt bekommen hatte, spendete er eine Million US-Dollar an den ‘Alzheimer Research Trust’. Pratchett führte in diesem Zusammenhang eine Kampagne gegen das Verbot der Sterbehilfe in Großbritannien, dazu produzierte er den BBC-Dokumentarfilm Choosing to die.173Jochen Wittmann: Pratchetts “Choosing to die: Selbstmord zur besten Sendezeit. In: derstandard.at. 15. Juni 2011, abgerufen am 27. Dezember 2014.
Im März 2008 machte Tilman Jens die Demenz vom Alzheimer-Typ seines Vaters Walter Jens (1923–2013) öffentlich.174Tilman Jens: Vaters Vergessen. In: FAZ.net. 4. März 2008, abgerufen am 27. Dezember 2014. Zwei Monate später machte Ursula von der Leyen die Alzheimer-Krankheit ihres Vaters, des ehemaligen niedersächsischen Ministerpräsidenten Ernst Albrecht (1930–2014), öffentlich bekannt.175Paul Wolff: Von der Leyen und die Krankheit ihres Vaters. In: welt.de. 27. Mai 2008, abgerufen am 27. Dezember 2014.
Der Suizid von Gunter Sachs lenkte im Mai 2011 erneut die öffentliche Aufmerksamkeit auf das Thema Alzheimer.176Zum Beispiel Titelthema in Die Zeit, 12. Mai 2011: Die Angst vor Alzheimer Im Februar 2012 ging Rudi Assauer mit seiner Alzheimer-Diagnose an die Öffentlichkeit.
Im Juli 2012 erklärte der kolumbianische Schriftsteller Gabriel García Márquez, der 1982 den Literaturnobelpreis verliehen bekam, an Demenz erkrankt zu sein.177Gabriel García Márquez: Literaturnobelpreisträger leidet an Demenz. In: Spiegel Online. 8. Juli 2012, abgerufen am 27. Dezember 2014.178Bitter irony of Alzheimer’s for Nobel laureate Marquez as his symptoms mimic masterpiece. Márquez verstarb am 17. April 2014. Im Oktober 2015 teilte der FC Bayern München in einer Pressemitteilung mit, dass der Fußballer Gerd Müller an der Alzheimer-Erkrankung leide und seit Februar 2015 in einem Fachpflegeheim betreut werde.179Gerd Müller wird 70. In: fcbayern.de. 6. Oktober 2015, abgerufen am 6. Oktober 2015.
Literatur
Literarisch verarbeitete der Schriftsteller Arno Geiger die Alzheimer-Erkrankung seines Vaters in dem Sachbuch Der alte König in seinem Exil, für das der Autor 2011 für den Preis der Leipziger Buchmesse nominiert war und das ihm einen Ehrenpreis des Deutschen Hospiz- und PalliativVerbandes einbrachte.180DHPV-Ehrenpreis an Arno Geiger auf www.dhpv.de, 10. Oktober 2011
Der Roman Hirngespinste von J. Bernlef, erstmals erschienen 1984 unter dem Titel Bis es wieder hell ist und 2007 neu aufgelegt, schildert die innere Erfahrungswelt eines Alzheimer-Kranken.
Der Autor Martin Suter veröffentlichte 1997 zum Thema Altersdemenz den Roman Small World, der mit Gérard Depardieu und Alexandra Maria Lara 2010 verfilmt wurde.
John Bayley, Iris Murdochs Witwer, veröffentlichte 1999 seine Erinnerungen an deren Alzheimer-Erkrankung in “Elegy for Iris”, was 2001 mit Kate Winslet und Judi Dench als Iris Murdoch verfilmt wurde.
Die Aktivistin Helga Rohra (* 1953), die mit 54 Jahren die Diagnose Lewy-Body-Demenz gestellt bekam, setzt sich für die Rechte Demenzkranker ein und veröffentlichte 2011 das Buch Aus dem Schatten treten – Warum ich mich für unsere Rechte als Demenzbetroffene einsetze.181Aus dem Schatten treten – Warum ich mich für unsere Rechte als Demenzbetroffene einsetze von Helga Rohra auf www.demenz-support.de
Einen Comic über eine Alzheimer-Geschichte zeichnete der spanische Künstler Paco Roca unter dem Titel Kopf in den Wolken, diese Graphic Novel erschien 2013. Das Buch handelt von erkrankten Menschen in einem Altersheim. „Die Geschichte lebt von authentischen Details, die Roca in seinem Bekannten- und Verwandtenkreis sowie durch die Recherche in einem Seniorenheim gesammelt hat. Es entfaltet sich eine Erzählung, die der Krankheit komische Seiten abgewinnt, ohne deren Tragik herunterzuspielen“, beurteilte Ralph Trommer in seiner Besprechung in der tageszeitung (taz) am 4. November 2013.182Ralph Trommer: Meister der leisen Töne. In: taz.de. 4. November 2013, abgerufen am 27. Dezember 2014. Es gibt eine Zeichentrick-Verfilmung von Kopf in den Wolken mit dem Titel Wrinkles.
Sarah Leavitt brachte den Comic Das große Durcheinander – Alzheimer, meine Mutter und ich 2013 heraus.
Eine Bearbeitung des Themas Alzheimer in Form von Lyrik nahm die österreichische Autorin und Sozialpädagogin Maria Seisenbacher mit ihrem Gedichtband Ruhig sitzen mit festen Schuhen vor (2015).
Im März 2016 veröffentlichte die Publizistin Inge Jens das Sachbuch Langsames Entschwinden: Vom Leben mit einem Demenzkranken über die Demenz ihres Ehemanns Walter Jens, eines ehemaligen Tübinger Rhetorikprofessors.
Die italienische Journalistin und Autorin Michela Farabella veröffentlichte im Jahre 2019 den autobiografischen Roman Italo, con te partirò183Michela Farabella: Italo, con te partirò. Hrsg.: Carello Edizioni. Turin 2019, ISBN 978-88-96864-81-4, S. 144., in dem sie die Leidensgeschichte ihres Vaters Italo Farabella schildert, der im Alter schwer von der Alzheimer-Krankheit betroffen war. Michela Farabella verbindet die Darstellung der sich in Turin zugetragenen tragischen Geschichte einer 4-jährigen Odyssee ihres Vaters zwischen Heimen für Demenzkranke und Krankenhäusern mit der Kritik am italienischen Gesundheitssystems im Umgang mit älteren Alzheimer-Patienten.
Film und Theater
In dem Theaterstück Ich muss gucken, ob ich da bin, erarbeitet von der Regisseurin Barbara Wachendorff, spielen auf der Bühne an Demenz erkrankte, ältere Schauspieler. Im Zentrum des Stücks, das 2006 für den Preis Der Faust nominiert war, steht die Lebenswelt der Betroffenen, ihre Wahrnehmung der Gegenwart und Vergangenheit.184Theatermacherin Barbara Wachendorff mit Stück über Demenz Außerdem schrieb Barbara Wachendorff das Theaterstück Anderland – Eine Reise ohne Ruder ins Land der Demenz, das im Mai 2012 im Bürgerhaus Stollwerck (Köln) Premiere feierte.185Interview mit Regisseurin Barbara Wachendorff. In: Sommerblut – Festival der Multipolarkultur. 7. Mai 2012, abgerufen am 9. August 2019.186Anderland – Demenz-Theaterstück
Der Regisseur Iain Dilthey veröffentlichte 2009 den drei Demenz-Geschichten umfassenden Episodenfilm Eines Tages…, mit den Schauspielern Horst Janson, Annekathrin Bürger und Heinrich Schafmeister. Der Spielfilm ist Teil einer Filmratgeber-DVD-Box des LVR-Zentrums für Medien und Bildung in Düsseldorf.187Eines Tages… Offizielle Homepage zum Spielfilm188DVD-Box Demenz. In: LVR-Klinikverbund. Landschaftsverband Rheinland (LVR), abgerufen am 9. August 2019.
Von einem alten Ehepaar, das mit dem Schlaganfall und der dadurch fortschreitenden Demenz der Ehefrau fertig werden muss, erzählt der Film Amour – Liebe des Regisseurs Michael Haneke, der 2012 für das Beziehungsdrama bei den Filmfestspielen in Cannes die Goldene Palme verliehen bekam.
Der Episodenfilm When yesterday comes erzählt in 77 Minuten vier verschiedene Geschichten zum Thema Demenz, realisiert durch die vier taiwanischen Regisseure Hsiu Chiung Chiang, Singing Chen, Wi Ding Ho und Ko Shang Shen.
Im Dokumentarfilm Vergiss mein nicht aus dem Jahr 2012 porträtierte der Regisseur David Sieveking seine an Alzheimer erkrankte Mutter.
Auch der Regisseur Armin Petras macht sich in seinem Theaterstück Demenz, Depression und Revolution, das 2013 am Berliner Maxim-Gorki-Theater seine Premiere feierte, Gedanken über altersbedingten Gedächtnisschwund, in fragmentarischen Sätzen, die den geistigen Zerfall symbolisieren, im Spiel mit Aussagen von dementen Patienten, Angehörigen und Medizinern. „Er gießt Kaffee auf den Teller, Brot in den Kaffee, Zeitung wird in die Limo getunkt“, lautet ein Auszug aus dem Theatertext.189Von Johan Dehoust: Maxim Gorki Theater: Stuhlkreis mit Kater. In: Spiegel Online. 2. Januar 2013, abgerufen am 27. Dezember 2014.
Der Fernsehfilm Die Auslöschung erzählt die Geschichte einer großen späten Liebe einer Restauratorin, gespielt von Martina Gedeck, und eines Kunsthistorikers, gespielt von Klaus Maria Brandauer. Ihre Beziehung verändert sich, als bei ihm die Alzheimer-Krankheit diagnostiziert wurde. Aus einer gleichberechtigten Partnerschaft entsteht nach und nach ein Pflegeverhältnis, die liebevolle Verbundenheit beider bleibt jedoch bestehen (Ausstrahlung im Sender Das Erste am 8. Mai 2013).
Der Regisseur Thomas Liesen produzierte 2013 unter dem Titel Leben, Lieben, Vergessen… eine dreijährige Langzeit-Dokumentation für Das Erste. Porträtiert wurde eine dreiköpfige Familie, die mit der genetisch bedingten Alzheimer-Erkrankung der 42-jährigen Mutter konfrontiert wird. Der Film behandelt die Entwicklung der Krankheit von der Diagnose im Frühstadium bis ins Endstadium und beschreibt die daraus resultierenden Belastungen und Einschränkungen der Familie im Alltag.190Thomas Liesen (Buch und Regie), Ulrike Schweitzer (Redaktion): Leben, Lieben, Vergessen… Längengrad-Filmproduktion, 2013 Online bei YouTube.
In der deutschen Tragikomödie Honig im Kopf (2014) von und mit Til Schweiger setzt sich Schweiger gemeinsam mit seiner Tochter Emma Schweiger und Dieter Hallervorden mit den Themen Alzheimer und Demenz auseinander.
Still Alice – Mein Leben ohne Gestern (Originaltitel: Still Alice) mit Julianne Moore in der Hauptrolle ist ein US-amerikanisch-französisches Filmdrama aus dem Jahr 2014 (2015 in Deutschland erschienen).191Filmdrama “Still Alice”, Infos und Bewertung auf score11.de, abgerufen am 12. September 2015.Es basiert auf der gleichnamigen Romanvorlage der Schriftstellerin Lisa Genova und beschäftigt sich mit dem Verlauf einer früh einsetzenden Variante von Alzheimer.
Herausforderung für Politik und Gesellschaft
Inzwischen wissen viele, dass die Alzheimer-Krankheit die häufigste Form – verantwortlich für 50 bis 80 Prozent der Fälle – geistigen Verfalls ist. An zweiter Stelle steht die gefäßbedingte Demenz: Durchblutungsstörungen durch Schlaganfälle oder verengte und verkalkte Schlagadern können das Gehirn so weit zerstören, dass eine Demenz auftritt. Häufig überlagern sich die beiden Demenz-Arten.
Die Alzheimer-Krankheit gilt auch als eine Belastung für das Gesundheitssystem. Da die Zahl sehr alter Menschen stark zugenommen hat und weiter zunimmt, nimmt die Zahl der Erkrankten immer weiter zu. Die Behandlungskosten sind für Kranken- und Pflegekassen eine wachsende finanzielle Herausforderung.192Wir müssen den Kampf gegen Alzheimer gewinnen193Belastung der Gesundheitssysteme und der Volkswirtschaft durch Alzheimer (PDF) In: Medical Tribune, 36/2009
Siehe auch
- Deutsche Alzheimer-Gesellschaft
- Alzheimer Forschung Initiative
- PAQUID-Kohortenstudie
- Heiko Braak#M. Alzheimer
Literatur
- Alois Alzheimer: Über eine eigenartige Erkrankung der Hirnrinde. Vortrag (3. November) auf der Versammlung Südwestdeutscher Irrenärzte in Tübingen am 3. und 4. November 1906. Eigenbericht Alzheimers in Allg. Zeitschrift für Psychiatrie und psychisch-gerichtliche Medizin, 1907, S. 146–148.
- T. A. Bayer, O. Wirths: Alzheimer-Demenz. Molekulare Pathologie, Tiermodelle und Therapiestrategien. In: Der Nervenarzt. 79 (Suppl 3), S. 117–128.
- Anne Eckert: Alois Alzheimer und die Alzheimer Krankheit. In: Pharmazie in unserer Zeit. Band 31 (4), 2002, S. 356–360.
- Hans Förstl, Alexander Kurz, Tobias Hartmann: Alzheimer-Demenz. In: Hans Förstl (Hrsg.): Demenzen in Theorie und Praxis. 3. Auflage. Springer, Berlin u. a. 2011, ISBN 978-3-642-19794-9, S. 47–72.
- Kurt Jellinger (Hrsg.): Alzheimer – Meilensteine aus hundert Jahren wissenschaftlicher und klinischer Forschung. Akademische Verlagsgesellschaft AKA, Berlin 2006, ISBN 3-89838-077-7.
- Frank Jessen (Hrsg.): Handbuch Alzheimer-Krankheit. Grundlagen – Diagnostik – Therapie – Versorgung – Prävention. De Gruyter, Berlin 2018, ISBN 978-3-11-040345-9.
- Cornelia Stolze: Vergiss Alzheimer! Die Wahrheit über eine Krankheit, die keine ist. Kiepenheuer & Witsch, Köln 2011, ISBN 3-462-04339-0.
- Randall J. et al.: Clinical and Biomarker Changes in Dominantly Inherited Alzheimer’s Disease. In: New England Journal of Medicine. 2012, S. 120723122607004, doi:10.1056/NEJMoa1202753.
- Michael Jürgs: Alzheimer: Spurensuche im Niemandsland. Bertelsmann Taschenbuch, München 2006, ISBN 978-3-570-00934-5.
- Margret Lock: The Alzheimer Conundrum: Entanglements of Dementia and Aging. Princeton University Press 2013, ISBN 978-0-691-14978-3.
Weblinks
- Commons: Alzheimer-Krankheit – Sammlung von Bildern, Videos und Audiodateien
- Wikiversity: Erstbeschreibung der Alzheimerschen Erkrankung – Kursmaterialien
- Makroskopisches Präparat eines Alzheimer-Patienten und histologisches Präparat
- Wegweiser Demenz des Bundesministeriums für Familie, Senioren, Frauen und Jugend
- Infoportal Demenz Website der Alzheimer Gesellschaft Baden-Württemberg
- Die großen Volkskrankheiten: Alzheimer TV-Dokumentation der ARD als YouTube-Video (41:36 Min.), Beschreibung bei 3sat.de
Einzelnachweise
Quellen und Tiefen
- 1C. P. Ferri et al.: Global prevalence of dementia: a Delphi consensus study. In: Lancet, Band 366, Nr. 9503, Dezember 2005, S. 2112–2117, doi:10.1016/S0140-6736(05)67889-0. PMID 16360788. PMC 2850264 (freier Volltext).
- 2Elisabeth Stechl, Catarina Knüvener et al.: Praxishandbuch Demenz. Erkennen – Verstehen – Behandeln. Mabuse-Verlag, Frankfurt am Main 2012, ISBN 978-3-86321-038-0.
- 3R. Mahlberg, H. Gutzmann (Hrsg.): Demenzerkrankungen erkennen, behandeln und versorgen. Deutscher Ärzte-Verlag, Köln 2009, ISBN 978-3-7691-0563-6.
- 4Sabine Engel: Alzheimer und Demenzen. Unterstützung für Angehörige. Trias-Verlag, Stuttgart 2012, ISBN 978-3-8304-3983-7.
- 5R. Mahlberg, H. Gutzmann (Hrsg.): Demenzerkrankungen erkennen, behandeln und versorgen. Deutscher Ärzte-Verlag, Köln 2012, ISBN 978-3-7691-0563-6.
- 6Skript (Memento vom 21. September 2008 im Internet Archive) (PDF; 612 kB) der Sendung Quarks & Co zum Thema Alzheimer
- 7Alexandra Bröhm: Warum Frauen häufiger an Alzheimer erkranken. In: welt.de. Axel Springer SE, 31. Mai 2016, abgerufen am 30. Dezember 2019
- 8Jane Gilmore: A possible ‘link’ between menopause and Alzheimer’s is scaring women, including me. In: The Sydney Morning Herald. 7. Juni 2019, abgerufen am 30. Dezember 2019 (englisch).
- 9Deutsche Alzheimer Gesellschaft e. V.: Die Häufigkeit von Demenzerkrankungen. (PDF) Infoblatt 1. In: deutsche-alzheimer.de. Juni 2018, abgerufen am 9. August 2019.
- 10World Alzheimer Report 2015. The Global Impact of Dementia. (PDF) An analysis of prevalence, Incidence, cost and trends. Alzheimer’s Disease International (ADI), August 2015, abgerufen am 9. August 2019 (englisch).
- 11D. Kapl, K. A. Rudolphi: Neue pharmakologische Aspekte zum neurologischen Profil von Propentofyllin. In: Tierärztliche Praxis (26)(K), 1998, S. 317–321
- 12“Die Ursachen der Alzheimer-Krankheit sind bislang nicht vollständig geklärt. Die bisherige Forschung zeigt, dass an ihrer Entstehung mehrere Faktoren beteiligt sind.” In: Elisabeth Stechl, Catarina Knüvener et al.: Praxishandbuch Demenz. Erkennen – Verstehen – Behandeln. Mabuse-Verlag, Frankfurt am Main 2012, ISBN 978-3-86321-038-0., S. 192
- 13“Obgleich die Ätiologie der Alzheimer-Demenz letztlich weiterhin als ungeklärt bezeichnet werden muss, gab es doch in den letzten Jahren einen deutlichen Wissenszuwachs in der Pathologie der Erkrankung, in erster Linie auf der Basis von genetischen und molekularbiologischen Untersuchungen.” In: R. Mahlberg, H. Gutzmann (Hrsg.): Demenzerkrankungen erkennen, behandeln und versorgen. Deutscher Ärzte-Verlag, Köln 2009, ISBN 978-3-7691-0563-6., S. 11 f.
- 14J. J. Iliff et al.: Impairment of glymphatic pathway function promotes tau pathology after traumatic brain injury. In: The Journal of neuroscience: the official journal of the Society for Neuroscience. Band 34, Nr. 49, Dezember 2014, S. 16180–16193, doi:10.1523/JNEUROSCI.3020-14.2014, PMID 25471560, PMC 4252540 (freier Volltext).
- 15J. M. Tarasoff-Conway et al.: Clearance systems in the brain-implications for Alzheimer disease. In: Nature reviews. Neurology. Band 11, Nr. 8, August 2015, S. 457–470, doi:10.1038/nrneurol.2015.119, PMID 26195256, PMC 4694579 (freier Volltext) (Review).
- 16J. J. Iliff et al.: Impairment of glymphatic pathway function promotes tau pathology after traumatic brain injury. In: The Journal of neuroscience: the official journal of the Society for Neuroscience. Band 34, Nr. 49, Dezember 2014, S. 16180–16193, doi:10.1523/JNEUROSCI.3020-14.2014, PMID 25471560, PMC 4252540 (freier Volltext).
- 17
- 18T. Jonsson et al.: A mutation in APP protects against Alzheimer’s disease and age-related cognitive decline. In: Nature. Band 488, Nr. 7409, August 2012, S. 96–99, doi:10.1038/nature11283. PMID 22801501.
- 19E. Rogaeva et al.: The neuronal sortilin-related receptor SORL1 is genetically associated with Alzheimer disease. In: Nature genetics. Band 39, Nr. 2, Februar 2007, S. 168–177, doi:10.1038/ng1943. PMID 17220890. PMC 2657343 (freier Volltext).
- 20F. Lopera et al.: Clinical features of early-onset Alzheimer disease in a large kindred with an E280A presenilin-1 mutation. In: JAMA. Band 277, Nr. 10, März 1997, S. 793–799, PMID 9052708.
- 21Pam Belluck: Alzheimer’s Stalks a Colombian Family. In: nytimes.com. 1. Juni 2010, abgerufen am 27. Juli 2015 (englisch).
- 22PSEN1 E280A (Paisa). In: alzforum.org. Abgerufen am 27. Juli 2015 (englisch).
- 23Andreas Kleinschmidt: Alzheimer Früherkennung. In: siemens.com. 15. April 2013, abgerufen am 27. Juli 2015.
- 24. Panza et al.: Amyloid-based immunotherapy for Alzheimer’s disease in the time of prevention trials: the way forward. In: Expert review of clinical immunology. Band 10, Nr. 3, März 2014, S. 405–419, doi:10.1586/1744666X.2014.883921, PMID 24490853 (Review).
- 25F. Panza et al.: Is there still any hope for amyloid-based immunotherapy for Alzheimer’s disease? In: Current opinion in psychiatry. Band 27, Nr. 2, März 2014, S. 128–137, doi:10.1097/YCO.0000000000000041, PMID 24445401 (Review).
- 26
- 27Klinische Studie (Phase I): A Multiple Ascending Dose Study of COR388 bei Clinicaltrials.gov der NIH
- 28S. J. Soscia et al.: The Alzheimer’s disease-associated amyloid beta-protein is an antimicrobial peptide. In: PloS one. Band 5, Nr. 3, 2010, S. e9505, doi:10.1371/journal.pone.0009505. PMID 20209079. PMC 2831066 (freier Volltext).
- 29Stephen S. Dominy et al.: Porphyromonas gingivalis in Alzheimer’s disease brains: Evidence for disease causation and treatment with small-molecule inhibitors In: Science Advances. Band 5, Nr. 1, 2019,
- 30
- 31Klinische Studie (Phase I): A Multiple Ascending Dose Study of COR388 bei Clinicaltrials.gov der NIH
- 32Michiyo Iba, Jing L. Guo, Jennifer D. McBride, Bin Zhang, John Q. Trojanowski und Virginia M.-Y. Lee: Synthetic Tau Fibrils Mediate Transmission of Neurofibrillary Tangles in a Transgenic Mouse Model of Alzheimer’s-Like Tauopathy In: The Journal of Neuroscience. Nr. 33, 16. Januar 2013, S. 1024–1037.
- 33R. Mayeux, R. Ottman, M. Tang, L. Noboa-Bauza, K. Marder, B. Gurland, Y. Stern: Genetic susceptibility and head injury as risk factors for Alzheimer’s disease among community-dwelling elderly persons and their first-degree relatives. In: Ann Neurol. Band 33, Nr. 5, 1993, S. 494–501, PMID 8498827.
- 34K. F. Neumann, L. Rojo, L. P. Navarrete, G. Farías, P. Reyes, R. B. Maccioni: Insulin resistance and Alzheimer’s disease: molecular links & clinical implications. In: Curr Alzheimer Res.:. Nr. 5 (5), Oktober 2008, S. 438–447, PMID 18855585.
- 35J. S. Roriz-Filho, T. M. Sá-Roriz, I. Rosset, A. L. Camozzato, A. C. Santos, M. L. Chaves, J. C. Moriguti, M. Roriz-Cruz: (Pre)diabetes, brain aging, and cognition. In: Biochim Biophys Acta. 2009, S. 432–443, PMID 19135149.
- 36W. Q. Qiu, M. F. Folstein: Insulin, insulin-degrading enzyme and amyloid-beta peptide in Alzheimer’s disease: review and hypothesis. In: Neurobiol Aging. Feb; 27 (2), 2006, S. 190–198, PMID 19135149.
- 37O. S. Kofman, V. H. Macmillan: Diffuse cerebral atrophy. In: Applied therapeutics. Band 12, Nr. 4, April 1970, S. 24–26, PMID 5446326.
- 38M. Crisby, L. Carlson, B. Winblad: Statins in the prevention and treatment of Alzheimer disease. In: Alzheimer Disease & Associated Disorders. Band 16, Nr. 3, 2002, S. 131–136, PMID 12218642.
- 39P. Kehoe, G. Wilcock: Is inhibition of the renin-angiotensin system a new treatment option for Alzheimer’s disease? In: Lancet neurology. Band 6, Nr. 4, 2007, S. 373–378, PMID 17362841.
- 40„Why stroke ups Alzheimer’s risk“ BBC, vom 4. Juni 2007
- 41Nigel Hawkes: Alzheimers linked to aluminium pollution in tap water. In: The Times. 20. April 2006, abgerufen am 7. April 2010.
- 42Virginie Rondeau, Daniel Commenges, Hélène Jacqmin-Gadda, Jean-François Dartigues: Relation between Aluminum Concentrations in Drinking Water and Alzheimer’s Disease: An 8-year Follow-up Study. In: Am J Epidemiology. 2000, PMID 10901330 (Online).
- 43V. Rondeau, H. Jacqmin-Gadda, D. Commenges, C. Helmer, J.-F. Dartigues: Aluminum and Silica in Drinking Water and the Risk of Alzheimer’s Disease or Cognitive Decline: Findings From 15-Year Follow-up of the PAQUID Cohort. In: American Journal of Epidemiology. Band 169, Nr. 4, 2008, S. 489–496, doi:10.1093/aje/kwn348, PMID 19064650, PMC 2809081 (freier Volltext).
- 44Sakae Yumoto, Shigeo Kakimi, Akihiro Ohsaki, Akira Ishikawa: Demonstration of aluminum in amyloid fibers in the cores of senile plaques in the brains of patients with Alzheimer’s disease. In: Journal of Inorganic Biochemistry. Band 103, Nr. 11, 2009, S. 1579–84, doi:10.1016/j.jinorgbio.2009.07.023, PMID 19744735.
- 45P. C. Ferreira, A. Piai Kde, A. M. Takayanagui, S. I. Segura-Muñoz: Aluminum as a risk factor for Alzheimer’s disease. In: Rev Lat Am Enfermagem. Band 16, Nr. 1, 2008, S. 151–157, doi:10.1590/S0104-11692008000100023, PMID 18392545 (Online).
- 46Alzheimer’s Society: Aluminium and Alzheimer’s disease. (PDF) In: The Learning Exchange. Juni 2002, abgerufen am 9. August 2019 (englisch).
- 47Bundesinstituts für Risikobewertung: Keine Alzheimer-Gefahr durch Aluminium aus Bedarfsgegenständen (PDF; 8 Seiten, 65 kB), am 4. Oktober 2013.
- 48Bundesinstitut für Risikobewertung: Aluminiumhaltige Antitranspirantien tragen zur Aufnahme von Aluminium bei. (PDF; 15 Seiten), am 10. März 2014
- 49Lilian Calderón-Garcidueñas et al.: Hallmarks of Alzheimer disease are evolving relentlessly in Metropolitan Mexico City infants, children and young adults. APOE4 carriers have higher suicide risk and higher odds of reaching NFT stage V at ≤ 40 years of age. In: Environmental Research, 164, 2018, S. 475, doi:10.1016/j.envres.2018.03.023.
- 50Hirnleistungs-Check zur Früherkennung einer Demenz. IGeL-Monitor; abgerufen am 15. Januar 2019. Wichtigste Quellen darin: Meta-Analyse Tsoi 2016. – KK Tsoi, HW Hirai, JY Chan, TC. Kwok: Time to Treatment Initiation in People With Alzheimer Disease: A Meta-Analysis of Randomized Controlled Trials. In: Journal of the American Medical Directors Association, 2016, 17, S. 24–30, PMID 26392193; sowie Systematisches Review Lin et al. 2013 – J. S. Lin, E. O’Connor, R. C. Rossom, L. A. Perdue, E. Eckstrom: Screening for cognitive impairment in older adults: A systematic review for the U.S. Preventive Services Task Force. In: Annals of internal medicine, 2013, 159, S. 601–612, PMID 24354019. Mehr zur Begründung der Bewertung in Evidenz kompakt. (PDF) abgerufen am 15. Januar 2019.
- 51AWMF: S3-Leitlinie “Demenzen”. Abgerufen am 7. Januar 2021.
- 52MRT zur Früherkennung einer Alzheimer-Demenz. IGeL-Monitor; abgerufen am 15. Januar 2019. Wichtigste Quellen darin: NICE-Leitlinie von 2011. (National Institute for Health and Clinical Excellence der britischen Gesundheitsbehörde NHS) sowie Meta-Analyse Schmand et al. 2010. – B. Schmand, H. M. Huizenga, W. A. van Gool: Meta-analysis of CSF and MRI biomarkers for detecting preclinical Alzheimer’s disease. In: Psychological Medicine, Januar 2010, 40 (1): S. 135–145, PMID 19863841. Mehr zur Begründung der Bewertung in der Evidenzsynthese. (PDF) abgerufen am 15. Januar 2019.
- 53Artikel aus dem Tagesspiegel. vom 21. Februar 2018 oder aus der Ärzte-Zeitung. vom 5. Dezember 2017.
- 54G. B. Frisoni et al.: Revised criteria for Alzheimer’s disease: what are the lessons for clinicians? In: The Lancet. Neurology. Band 10, Nr. 7, Juli 2011, S. 598–601, doi:10.1016/S1474-4422(11)70126-0. PMID 21683925.
- 557 Stufen von Alzheimer | Deutschland. Abgerufen am 15. April 2021.
- 56R. T. Linn et al.: The ‘preclinical phase’ of probable Alzheimer’s disease. A 13-year prospective study of the Framingham cohort. In: Arch Neurol. Band 52, Nr. 5, 1995, S. 485–490, PMID 7733843.
- 57J. Saxton et al.: Preclinical Alzheimer disease: neuropsychological test performance 1.5 to 8 years prior to onset. In: Neurology. Band 63, Nr. 12, 2004, S. 2341–2347, PMID 15623697.
- 58E. W. Twamley, S. A. Ropacki, M. W. Bondi: Neuropsychological and neuroimaging changes in preclinical Alzheimer’s disease. In: J Int Neuropsychol Soc. Band 12, Nr. 5, 2006, S. 707–735, doi:10.1017/S1355617706060863, PMID 16961952.
- 59G. B. Frisoni et al.: Revised criteria for Alzheimer’s disease: what are the lessons for clinicians? In: The Lancet. Neurology. Band 10, Nr. 7, Juli 2011, S. 598–601, doi:10.1016/S1474-4422(11)70126-0. PMID 21683925.
- 60G. B. Frisoni et al.: Revised criteria for Alzheimer’s disease: what are the lessons for clinicians? In: The Lancet. Neurology. Band 10, Nr. 7, Juli 2011, S. 598–601, doi:10.1016/S1474-4422(11)70126-0. PMID 21683925.
- 61R. A. Sperling et al.: Toward defining the preclinical stages of Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. In: Alzheimer’s & dementia. Band 7, Nr. 3, Mai 2011, S. 280–292, doi:10.1016/j.jalz.2011.03.003. PMID 21514248. PMC 3220946 freier Volltext.
- 62M. S. Albert et al.: The diagnosis of mild cognitive impairment due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. In: Alzheimer’s & dementia: the journal of the Alzheimer’s Association. Band 7, Nr. 3, Mai 2011, S. 270–279, doi:10.1016/j.jalz.2011.03.008. PMID 21514249. PMC 3312027 (freier Volltext).
- 63G. M. McKhann et al.: The diagnosis of dementia due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. In: Alzheimer’s & dementia: the journal of the Alzheimer’s Association. Band 7, Nr. 3, Mai 2011, S. 263–269, doi:10.1016/j.jalz.2011.03.005. PMID 21514250. PMC 3312024 (freier Volltext).
- 64H.-J. Gertz, A. Kurz: Diagnose ohne Therapie. Frühdiagnostik der Alzheimer-Krankheit im Stadium der leichten kognitiven Beeinträchtigung. In: Der Nervenarzt. Band 82, Nr. 9, 2011, doi:10.1007/s00115-010-3213-3
- 65H. Barthel et al.: Cerebral amyloid-β PET with florbetaben (18F) in patients with Alzheimer’s disease and healthy controls: a multicentre phase 2 diagnostic study. In: The Lancet. Neurology. Band 10, Nr. 5, Mai 2011, S. 424–435, doi:10.1016/S1474-4422(11)70077-1. PMID 21481640.
- 66Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V – Florbetaben, Beschluss des G-BA “neue Untersuchungsmethode” vom 20. Februar 2014, abgerufen am 6. März 2014
- 67Thomas Hauser et al..: Mild cognitive impairment. Diagnostische Wertigkeit verschiedener MRT-Techniken. In: Der Radiologe. 2011; 51: S. 285–292 doi:10.1007/s00117-010-2094-6
- 68Marcus Bauser, Lutz Lehmann: Positronen-Emissions-Tomographie. In: Chemie in unserer Zeit. Band 46, Nr. 2, 2012, S. 94, doi:10.1002/ciuz.201200564.
- 69M. S. Albert et al.: The diagnosis of mild cognitive impairment due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. In: Alzheimer’s & dementia: the journal of the Alzheimer’s Association. Band 7, Nr. 3, Mai 2011, S. 270–279, doi:10.1016/j.jalz.2011.03.008. PMID 21514249. PMC 3312027 (freier Volltext).
- 70L. Mucke: Neuroscience: Alzheimer’s disease. In: Nature. Band 461, 2009, S. 895–897, PMID 19829367.
- 71H. Förstl, A. Kurz: Clinical features of Alzheimer’s disease. In: European Archives of Psychiatry and Clinical Neuroscience. Band 249, Nr. 6, 1999, S. 288–290, PMID 10653284.
- 72G. A. Carlesimo, M. Oscar-Berman: Memory deficits in Alzheimer’s patients: a comprehensive review. In: Neuropsychology Review. Band 3, Nr. 2, 1992, S. 119–169, PMID 1300219.
- 73M. Jelicic, A. E. Bonebakker, B. Bonke: Implicit memory performance of patients with Alzheimer’s disease: a brief review. In: International psychogeriatrics / IPA. Band 7, Nr. 3, 1995, S. 385–392, PMID 8821346.
- 74E. M. Frank: Effect of Alzheimer’s disease on communication function. In: Journal of the South Carolina Medical Association (1975). Band 90, Nr. 9, 1994, S. 417–423, PMID 7967534.
- 75J. T. Becker, A. A. Overman: [The semantic memory deficit in Alzheimer’s disease]. In: Revista De Neurologia. Band 35, Nr. 8, 2002, S. 777–783, PMID 12402233.
- 76J. R. Hodges, K. Patterson: Is semantic memory consistently impaired early in the course of Alzheimer’s disease? Neuroanatomical and diagnostic implications. In: Neuropsychologia. Band 33, Nr. 4, 1995, S. 441–459, PMID 7617154.
- 77T. Benke: Two forms of apraxia in Alzheimer’s disease. In: Cortex; a Journal Devoted to the Study of the Nervous System and Behavior. Band 29, Nr. 4, 1993, S. 715–725, PMID 8124945.
- 78H. Förstl, A. Kurz: Clinical features of Alzheimer’s disease. In: European Archives of Psychiatry and Clinical Neuroscience. Band 249, Nr. 6, 1999, S. 288–290, PMID 10653284.
- 79Liz Kumru: Getting Lost in Alzheimer’s. UNMC; abgerufen am 22. Juli 2007 unmc.edu (Memento vom 10. Mai 2001 im Internet Archive)
- 80Tom Rickey: Road Skills Hint At “Motion Blindness” Of Alzheimer’s. University of Rochester Medical Center, 31. Januar 2002, abgerufen am 25. März 2016.
- 81Konzepte für Alzheimer-Impfungen im Testlabor. In: Deutsches Ärzteblatt. 9. November 2017, abgerufen am 9. August 2019.
- 82Antikörper löst Amyloid bei Alzheimer-Patienten.Ärzte Zeitung, 21. Mai 2010, abgerufen am 6. November 2010.
- 83rme/aerzteblatt.de: Alzheimer: Zweite Studie zur Antikörpertherapie abgebrochen. In: aerzteblatt.de. 7. August 2012, abgerufen am 27. Dezember 2014.
- 84Oliver Wirths et al.: Identification of low molecular weight pyroglutamate A{beta} oligomers in Alzheimer disease: a novel tool for therapy and diagnosis. In: The Journal of Biological Chemistry. Band 285, Nr. 53, 2010, S. 41517–41524, doi:10.1074/jbc.M110.178707, PMID 20971852, PMC 3009878 (freier Volltext)..
- 85Stefan Weller: Therapie gegen Alzheimer: Göttinger Forscher entwickeln neuen Ansatz für passive Immunisierung. Universitätsmedizin Göttingen – Georg-August-Universität, Pressemitteilung vom 5. November 2010 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 6. November 2010.
- 86Gary W. Small: What we need to know about age related memory loss. In: British Medical Journal. 22. Juni 2002, abgerufen am 5. November 2006.
- 87M. Z. Scalco, R. van Reekum: Prevention of Alzheimer disease. Encouraging evidence. In: Canadian family physician Médecin de famille canadien. Band 52, Februar 2006, S. 200–207, PMID 16529393. PMC 1479722 (freier Volltext). (Review).
- 88Sam Norton et al.: Potential for primary prevention of Alzheimer’s disease: an analysis of population-based data. In: The Lancet Neurology. Band 13, Nr. 8, 2014, S. 788–794, doi:10.1016/S1474-4422(14)70136-X (Online).
- 89K. A. Ginis et al.: Formulation of evidence-based messages to promote the use of physical activity to prevent and manage Alzheimer’s disease. In: BMC Public Health. Band 17, Nr. 1, Februar 2017, S. 209, doi:10.1186/s12889-017-4090-5, PMID 28212648, PMC 5316179 (freier Volltext).
- 90Äpfel fürs Hirn. Auf: wissenschaft.de vom 19. November 2004.
- 91Mit Fischöl gegen das Vergessen. Auf: wissenschaft.de vom 2. September 2004.
- 92M. Morris, J. Schneider, C. Tangney: Thoughts on B-vitamins and dementia. In: J Alzheimers Dis. Band 9, Nr. 4, 2006, S. 429–433, PMID 16917152.
- 93Inna I. Kruman et al.: Folic Acid Deficiency and Homocysteine Impair DNA Repair in Hippocampal Neurons and Sensitize Them to Amyloid Toxicity in Experimental Models of Alzheimer’s Disease. In: The Journal of Neuroscience. Band 22, Nr. 5, 1. März 2002, PMID 11880504. Einen vereinfachten Bericht findet man hier: www.alzheimers.org.uk
- 94Folate May Lower Alzheimer’s Risk In: CBS news, reporting from WebMD.
- 95NIH Press Release: Folic Acid Possibly A Key Factor In Alzheimer’s Disease Prevention. (Nicht mehr online verfügbar.) In: nih.gov. 3. Januar 2002, archiviert vom Original am 24. Juni 2014; abgerufen am 29. Dezember 2019.
- 96Kathleen Fackelmann: USATODAY.com – Folate shows promise in preventing Alzheimer’s. In: usatoday.com. 14. August 2005, abgerufen am 27. Dezember 2014.
- 97Raucher-Ausrede widerlegt. Auf: wissenschaft.de vom 8. Februar 2005.
- 98D. E. Zylberstein et al.: Midlife homocysteine and late-life dementia in women. A prospective population study. In: Neurobiology of aging. Band 32, Nr. 3, März 2011, S. 380–386, doi:10.1016/j.neurobiolaging.2009.02.024. PMID 19342123.
- 99A. D. Smith et al.: Homocysteine-lowering by B vitamins slows the rate of accelerated brain atrophy in mild cognitive impairment: a randomized controlled trial. In: PloS one. Band 5, Nr. 9, 2010, S. e12244, doi:10.1371/journal.pone.0012244. PMID 20838622. PMC 2935890 (freier Volltext).
- 100G. Douaud et al.: Preventing Alzheimer’s disease-related gray matter atrophy by B-vitamin treatment. In: Proceedings of the National Academy of Sciences. Band 110, Nr. 23, Juni 2013, S. 9523–9528, doi:10.1073/pnas.1301816110. PMID 23690582. PMC 3677457 (freier Volltext).
- 101Die Wunderwaffe gegen Alzheimer. In: vitamin-b12-mangel.org. Juli 2013, abgerufen am 27. Dezember 2014.
- 102Andrea Gerlin: Vitamins That Cost Pennies a Day Seen Delaying Dementia – Businessweek. In: businessweek.com. 20. Mai 2013, abgerufen am 27. Dezember 2014.
- 103Education May Not Protect Against Dementia as Previously Thought. Rush University, 6. Februar 2019, abgerufen am 9. August 2019 (englisch).
- 104Roy Eccleston: Think or sink. (PDF) (Nicht mehr online verfügbar.) In: The Weekend Australian Magazine. 2. Dezember 2006, archiviert vom Original am 23. Juli 2008; abgerufen am 3. Januar 2009.
- 105Kreuzworträtsel lösen reicht nicht. (Nicht mehr online verfügbar.) In: GesundheitPro.de. 8. November 2007, archiviert vom Original am 10. Juli 2009; abgerufen am 3. Januar 2009.
- 106Blutdruck senkende Mittel können Demenz vorbeugen. wissenschaft.de, 14. Oktober 2002.
- 107A. Brüning: Wie Cholesterin das Risiko für Alzheimer erhöht. In: Berliner Zeitung, 11. Oktober 2005.
- 108Berliner Zeitung, 24. Oktober 2013, S. 12.
- 109J. P. Guo, S. Yu, PL. McGeer: Simple in vitro assays to identify amyloid-beta aggregation blockers for Alzheimer’s disease therapy. In: J Alzheimers Dis. Band 19, Nr. 4, 2010, S. 1359–1370, PMID 20061605.
- 110S, Abbas, M. Mink: Epigallocatechin gallate inhibits beta amyloid oligomerization in Caenorhabditis elegans and affects the daf-2/insulin-like signaling pathway. In: J Alzheimers Dis. Band 17, Nr. 11, 2010, S. 902–909, PMID 20382008.
- 111D. E. Ehrnhoefer et al.: EGCG redirects amyloidogenic polypeptides into unstructured, off-pathway oligomers. In: Nat Struct Mol Biol. Band 15, Nr. 5, Juni 2008, S. 558–566, PMID 18511942.
- 112J. Bieschke et al.: EGCG remodels mature α-synuclein and amyloid-β fibrils and reduces cellular toxicity. In: Proc Natl Acad Sci USA. Band 107, Nr. 17, April 2010, PMID 20385841.
- 113F. Meng et al.: The flavanol (–)-epigallocatechin 3-gallate inhibits amyloid formation by islet amyloid polypeptide, disaggregates amyloid fibrils, and protects cultured cells against IAPP-induced toxicity. In: Biochemistry. Band 49, Nr. 37, September 2010, PMID 20707388.
- 114K. Rezai-Zadeh et al.: Green tea epigallocatechin-3-gallate (EGCG) reduces beta-amyloid mediated cognitive impairment and modulates tau pathology in Alzheimer transgenic mice. In: Brain Res. Band 12, Nr. 1214, Juni 2008, S. 177–186, PMID 18457818.
- 115
- 116G. Grelle et al.: Black Tea Theaflavins Inhibit Formation of Toxic Amyloid-β and α-Synuclein Fibrils. In: Biochemistry. November 2011, PMID 22054421.
- 117P. E. Cramer et al.: ApoE-directed therapeutics rapidly clear β-amyloid and reverse deficits in AD mouse models. In: Science. Band 335, Nr. 6075, März 2012, S. 1503–1506, doi:10.1126/science.1217697. PMID 22323736. PMC 3651582 (freier Volltext).
- 118Jessica Studeny: Drug quickly reverses Alzheimer’s symptoms in mice. Veröffentlichung der Case Western Reserve University, 9. Februar 2012.
- 119Drug Quickly Reverses Alzheimer’s Symptoms in Mice. Meldung bei Neurosciencenews.com vom 10. Februar 2012.
- 120Harald Frater: Krebsmedikament macht Alzheimer-Symptome rückgängig: Wirkstoff Bexaroten beseitigt Gedächtnisstörungen und Eiweiß-Plaques bei Mäusen. In: g-o.de. 10. Februar 2012, abgerufen am 27. Dezember 2014.
- 121E. O’Hare et al.: Lack of support for bexarotene as a treatment for Alzheimer’s disease. In: Neuropharmacology. [elektronische Veröffentlichung vor dem Druck] Mai 2015, doi:10.1016/j.neuropharm.2015.04.020, PMID 26025659.
- 122C. Balducci et al.: The Continuing Failure of Bexarotene in Alzheimer’s Disease Mice. In: Journal of Alzheimer’s disease: JAD. [elektronische Veröffentlichung vor dem Druck] März 2015, doi:10.3233/JAD-150029, PMID 25777514.
- 123B. Tousi: The emerging role of bexarotene in the treatment of Alzheimer’s disease: current evidence. In: Neuropsychiatric disease and treatment. Band 11, 2015, S. 311–315, doi:10.2147/NDT.S61309, PMID 25709453, PMC 4327563 (freier Volltext) (Review).
- 124Weblink für Paper Paul T. Francis, Gordon K. Wilcock et al.: The cholinergic hypothesis of Alzheimer’s disease: a review of progress In: J Neurol Neurosurg Psychiatry (1999)
- 125Huperzine A Alzheimer Research Forum
- 126B. S. Wang, H. Wang, Z. H. Wei, Y. Y. Song, L. Zhang, H. Z. Chen: Efficacy and safety of natural acetylcholinesterase inhibitor huperzine A in the treatment of Alzheimer’s disease: an updated meta-analysis. In: Journal of Neural Transmission. Band 116, Nr. 4, 2009, S. 457–465, doi:10.1007/s00702-009-0189-x, PMID 19221692.
- 127B. Winblad, J. Cummings, N. Andreasen et al.: A six-month double-blind, randomized, placebo-controlled study of a transdermal patch in Alzheimer’s disease – rivastigmine patch versus capsule. In: International Journal of Geriatric Psychiatry, Band 22, Nr. 5, S. 456–467, May 2007 doi:10.1002/gps.1788 PMID 17380489
- 128H. Kaduszkiewicz, T. Zimmermann, H. P. Beck-Bornholdt, Hendrik van den Bussche: Cholinesterase inhibitors for patients with Alzheimer’s disease: systematic review of randomised clinical trials. In: BMJ (Clinical Research Ed.). Band 331, Nr. 7512, August 2005, S. 321–327, PMID 16081444, PMC 1183129 (freier Volltext).
- 129T. Lempert, T. Bschor: [Treatment of Alzheimer’s disease according to the S3 guidelines on dementia. Choline esterase inhibitors for all and for ever?]. In: Der Nervenarzt. Band 82, Nr. 1, Januar 2011, S. 90–91, doi:10.1007/s00115-010-3233-z. PMID 21274696.
- 130J. C. Breitner, K. A. Welsh et al.: Delayed onset of Alzheimer’s disease with nonsteroidal anti-inflammatory and histamine H2 blocking drugs. In: Neurobiology of Aging Volume 16, Issue 4, Pages 523-530, July 1995 PMID 8544901
- 131T. Wyss-Coray, L. Mucke: Ibuprofen, inflammation and Alzheimer disease. In: Nature medicine. Band 6, Nr. 9, September 2000, S. 973–974, doi:10.1038/79661. PMID 10973311.
- 132D. Dokmeci: Ibuprofen and Alzheimer’s disease. In: Folia medica. Band 46, Nr. 2, 2004, S. 5–10, PMID 15506544. (Review).
- 133T. Morihara et al.: Ibuprofen suppresses interleukin-1beta induction of pro-amyloidogenic alpha1-antichymotrypsin to ameliorate beta-amyloid (Abeta) pathology in Alzheimer’s models. In: Neuropsychopharmacology: official publication of the American College of Neuropsychopharmacology. Band 30, Nr. 6, Juni 2005, S. 1111–1120, doi:10.1038/sj.npp.1300668. PMID 15688088.
- 134A. C. McKee et al.: Ibuprofen reduces Abeta, hyperphosphorylated tau and memory deficits in Alzheimer mice. In: Brain research. Band 1207, Mai 2008, S. 225–236, doi:10.1016/j.brainres.2008.01.095. PMID 18374906. PMC 2587244 (freier Volltext).
- 135M. Sastre et al.: Nonsteroidal anti-inflammatory drugs repress beta-secretase gene promoter activity by the activation of PPARgamma. In: Proceedings of the National Academy of Sciences. Band 103, Nr. 2, Januar 2006, S. 443–448, doi:10.1073/pnas.0503839103. PMID 16407166. PMC 1326151 (freier Volltext)./mfn] Beim Menschen liegen bisher keine Daten aus randomisierten Doppelblind-Studien vor, die eine gesicherte Wirkungsweise von Ibuprofen und anderen nichtsteroidalen Antirheumatika aufzeigen. Aufgrund der nicht unerheblichen Nebenwirkungen, die bei einer dauerhaften prophylaktischen Einnahme von Ibuprofen zu erwarten sind, wird von einer unkontrollierten Einnahme abgeraten.135N. Tabet, H. Feldmand: Ibuprofen for Alzheimer’s disease. In: The Cochrane database of systematic reviews. Nr. 2, 2003, S. CD004031, doi:10.1002/14651858.CD004031. PMID 12804498. (Review).
- 136B. De Strooper, G. König: An inflammatory drug prospect. In: Nature. Band 414, Nr. 6860, November 2001, S. 159–160, doi:10.1038/35102656. PMID 11700538.
- 137Gregor Larbig: Studien zur Identifizierung & Optimierung potentieller Wirkstoffe für die Behandlung von Morbus Alzheimer. Dissertation, TU Darmstadt, 2007
- 138T. Müller: Neue Wege gegen das Amyloid im Hirn. In: Ärzte Zeitung am 7. Dezember 2007
- 139M. Krohn et al.: Cerebral amyloid-β proteostasis is regulated by the membrane transport protein ABCC1 in mice. In: The Journal of clinical investigation. Band 121, Nr. 10, Oktober 2011, S. 3924–3931, doi:10.1172/JCI57867. PMID 21881209. PMC 3195473 (freier Volltext).
- 140R. McShane, A. Areosa Sastre, N. Minakaran: Memantine for dementia. In: The Cochrane database of systematic reviews. Nr. 2, 2006, S. CD003154, doi:10.1002/14651858.CD003154.pub5. PMID 16625572. (Review).
- 141J. Birks, Evans J. Grimley: Ginkgo biloba for cognitive impairment and dementia. In: Cochrane Database Syst Rev. Nr. 2, 2007, S. CD003120, doi:10.1002/14651858.CD003120.pub2, PMID 17443523
- 142J. Birks, E. Grimley, M. Van Dongen: Ginkgo biloba for cognitive impairment and dementia. In: Cochrane Database Syst Rev. S. CD003120, PMID 12519586.
- 143S. T. DeKosky, A. Fitzpatrick, D. G. Ives, J. Saxton, J. Williamson, O. L. Lopez, G. Burke, L. Fried, L. H. Kuller, J. Robbins, R. Tracy, N. Woolard, L. Dunn, R. Kronmal, R. Nahin, C. Furberg: The Ginkgo Evaluation of Memory (GEM) study: design and baseline data of a randomized trial of Ginkgo biloba extract in prevention of dementia. In: Contemp Clin Trials. Band 27, Nr. 3, 2006, S. 238–253, doi:10.1016/j.cct.2006.02.007, PMID 16627007.
- 144Ginkgo Biloba Does Not Reduce Dementia Risk, Study Shows. In: sciencedaily.com. 19. November 2008, abgerufen am 27. Dezember 2014.
- 145B. E. Snitz et al.: Ginkgo biloba for preventing cognitive decline in older adults: a randomized trial. In: JAMA. Band 302, Nr. 24, Dezember 2009, S. 2663–2670, doi:10.1001/jama.2009.1913. PMID 20040554. PMC 2832285 (freier Volltext).
- 146Stefan Weinmann et al.: Effects of Ginkgo biloba in dementia: systematic review and meta-analysis. In: BMC Geriatrics 2010, 10:14 doi:10.1186/1471-2318-10-14
- 147
- 148B. Kastenholz: Phytopharmaceuticals in the therapy of younger Alzheimer patients. WebmedCentral AGING 2011; 2 (7): WMC002011.
- 149S. Krishnan, R. Cairns, R. Howard: Cannabinoids for the treatment of dementia. In: The Cochrane database of systematic reviews. Nr. 2, 2009, S. CD007204, doi:10.1002/14651858.CD007204.pub2, PMID 19370677 (Review).
- 150S. Craft et al.: Intranasal insulin therapy for Alzheimer disease and amnestic mild cognitive impairment: a pilot clinical trial. In: Archives of neurology. Band 69, Nr. 1, Januar 2012, S. 29–38, doi:10.1001/archneurol.2011.233. PMID 21911655. PMC 3260944 (freier Volltext).
- 151M. W. Dysken et al.: Effect of vitamin E and memantine on functional decline in Alzheimer disease: the TEAM-AD VA cooperative randomized trial. In: JAMA. Band 311, Nr. 1, Januar 2014, S. 33–44, doi:10.1001/jama.2013.282834. PMID 24381967. PMC 4109898 (freier Volltext).
- 152M. Sano et al.: A controlled trial of selegiline, alpha-tocopherol, or both as treatment for Alzheimer’s disease. The Alzheimer’s Disease Cooperative Study. In: The New England Journal of Medicine. Band 336, Nr. 17, April 1997, S. 1216–1222, doi:10.1056/NEJM199704243361704. PMID 9110909.
- 153R. C. Petersen et al.: Vitamin E and donepezil for the treatment of mild cognitive impairment. In: The New England Journal of Medicine. Band 352, Nr. 23, Juni 2005, S. 2379–2388, doi:10.1056/NEJMoa050151. PMID 15829527.
- 154J. H. Kang et al.: A randomized trial of vitamin E supplementation and cognitive function in women. In: Archives of internal medicine. Band 166, Nr. 22, 2006 Dec 11-25, S. 2462–2468, doi:10.1001/archinte.166.22.2462. PMID 17159011.
- 155J. H. Kang et al.: Vitamin E, vitamin C, beta carotene, and cognitive function among women with or at risk of cardiovascular disease: The Women’s Antioxidant and Cardiovascular Study. In: Circulation. Band 119, Nr. 21, Juni 2009, S. 2772–2780, doi:10.1161/CIRCULATIONAHA.108.816900. PMID 19451353. PMC 2752297 (freier Volltext).
- 156E. R. Miller et al.: Meta-analysis: high-dosage vitamin E supplementation may increase all-cause mortality. In: Annals of internal medicine. Band 142, Nr. 1, Januar 2005, S. 37–46, PMID 15537682.
- 157Hilkka Soininen et al.: 24-month intervention with a specific multinutrient in people with prodromal Alzheimer’s disease (LipiDiDiet): a randomised, double-blind, controlled trial. In: The Lancet Neurology. Band 0, Nr. 0, ISSN 1474-4422, doi:10.1016/S1474-4422(17)30332-0 (Online ,abgerufen am 11. November 2017).
- 158Ärzte Zeitung: Europäische Studie: Hilft Nährstoff-Kombi bei Alzheimer im Frühstadium? Abgerufen am 11. November 2017.
- 159J. Cohen-Mansfield: Nonpharmacologic interventions for inappropriate behaviors in dementia: a review, summary, and critique. In: Am J Geriatr Psychiatry. 9 (4), 2001, S. 361–381. PMID 11739063 (Review)
- 160
- 161L. E. Middleton et al.: Activity energy expenditure and incident cognitive impairment in older adults. In: Archives of internal medicine. Band 171, Nr. 14, Juli 2011, S. 1251–1257, doi:10.1001/archinternmed.2011.277. PMID 21771893. PMC 3923462 (freier Volltext).
- 162M. N. Vercambre et al.: Physical activity and cognition in women with vascular conditions. In: Archives of internal medicine. Band 171, Nr. 14, Juli 2011, S. 1244–1250, doi:10.1001/archinternmed.2011.282. PMID 21771894. PMC 3153432 (freier Volltext).
- 163T. E. Dunne, S. A. Neargarder, P. B. Cipolloni, A. Cronin-Golomb: Visual contrast enhances food and liquid intake in advanced Alzheimer’s disease. In: Clin Nutr. Band 23, Nr. 4, 2004, S. 533–538, PMID 15297089.
- 164S3-Leitlinie Demenzen. 2017, doi:10.1007/978-3-662-53875-3.
- 165A. Alzheimer: Über eine eigenartige Erkrankung der Hirnrinde. In: Allg. Z. Psychiat. Psych.-Gerichtl. Med. Band 64, Nr. 1–2, 1907, S. 146–148.
- 166Konrad Maurer, Ulrike Maurer: Alzheimer: the life of a physician and the career of a disease. Columbia University Press, New York 2003.
- 167Fred H. Hochberg, David Rottenberg: Neurological classics in modern translation. Hafner Press, New York 1977, ISBN 0-02-851180-8.
- 168N. C. Berchtold, C. W. Cotman: Evolution in the conceptualization of dementia and Alzheimer’s disease: Greco-Roman period to the 1960s. In: Neurobiol. Aging. Band 19, Nr. 3, 1998, S. 173–189, PMID 9661992.
- 169Emil Kraepelin: Textbook of Psychiatry. 1910.
- 170M. B. Graeber et al.: Rediscovery of the case described by Alois Alzheimer in 1911: historical, histological and molecular genetic analysis. In: Neurogenetics. Band 1, Nr. 1, Mai 1997, S. 73–80, PMID 10735278.
- 171U. Müller, P. Winter, M. B. Graeber: A presenilin 1 mutation in the first case of Alzheimer’s disease. In: The Lancet. Neurology. Band 12, Nr. 2, Februar 2013, S. 129–130, doi:10.1016/S1474-4422(12)70307-1. PMID 23246540.
- 172Preisgekrönte Filmbiographie Iris von 2001. Darin wird die Geschichte ihres Verfalls aus der Sicht ihres Mannes John Bayley beschrieben. Murdoch wurde von Kate Winslet und Judi Dench dargestellt.
- 173Jochen Wittmann: Pratchetts “Choosing to die: Selbstmord zur besten Sendezeit. In: derstandard.at. 15. Juni 2011, abgerufen am 27. Dezember 2014.
- 174Tilman Jens: Vaters Vergessen. In: FAZ.net. 4. März 2008, abgerufen am 27. Dezember 2014.
- 175Paul Wolff: Von der Leyen und die Krankheit ihres Vaters. In: welt.de. 27. Mai 2008, abgerufen am 27. Dezember 2014.
- 176Zum Beispiel Titelthema in Die Zeit, 12. Mai 2011: Die Angst vor Alzheimer
- 177Gabriel García Márquez: Literaturnobelpreisträger leidet an Demenz. In: Spiegel Online. 8. Juli 2012, abgerufen am 27. Dezember 2014.
- 178Bitter irony of Alzheimer’s for Nobel laureate Marquez as his symptoms mimic masterpiece.
- 179Gerd Müller wird 70. In: fcbayern.de. 6. Oktober 2015, abgerufen am 6. Oktober 2015.
- 180DHPV-Ehrenpreis an Arno Geiger auf www.dhpv.de, 10. Oktober 2011
- 181Aus dem Schatten treten – Warum ich mich für unsere Rechte als Demenzbetroffene einsetze von Helga Rohra auf www.demenz-support.de
- 182Ralph Trommer: Meister der leisen Töne. In: taz.de. 4. November 2013, abgerufen am 27. Dezember 2014.
- 183Michela Farabella: Italo, con te partirò. Hrsg.: Carello Edizioni. Turin 2019, ISBN 978-88-96864-81-4, S. 144.
- 184
- 185Interview mit Regisseurin Barbara Wachendorff. In: Sommerblut – Festival der Multipolarkultur. 7. Mai 2012, abgerufen am 9. August 2019.
- 186
- 187Eines Tages… Offizielle Homepage zum Spielfilm
- 188DVD-Box Demenz. In: LVR-Klinikverbund. Landschaftsverband Rheinland (LVR), abgerufen am 9. August 2019.
- 189Von Johan Dehoust: Maxim Gorki Theater: Stuhlkreis mit Kater. In: Spiegel Online. 2. Januar 2013, abgerufen am 27. Dezember 2014.
- 190Thomas Liesen (Buch und Regie), Ulrike Schweitzer (Redaktion): Leben, Lieben, Vergessen… Längengrad-Filmproduktion, 2013 Online bei YouTube.
- 191Filmdrama “Still Alice”, Infos und Bewertung auf score11.de, abgerufen am 12. September 2015.
- 192
- 193Belastung der Gesundheitssysteme und der Volkswirtschaft durch Alzheimer (PDF) In: Medical Tribune, 36/2009
Quellen und Tiefen
- 1C. P. Ferri et al.: Global prevalence of dementia: a Delphi consensus study. In: Lancet, Band 366, Nr. 9503, Dezember 2005, S. 2112–2117, doi:10.1016/S0140-6736(05)67889-0. PMID 16360788. PMC 2850264 (freier Volltext).
- 2Elisabeth Stechl, Catarina Knüvener et al.: Praxishandbuch Demenz. Erkennen – Verstehen – Behandeln. Mabuse-Verlag, Frankfurt am Main 2012, ISBN 978-3-86321-038-0.
- 3R. Mahlberg, H. Gutzmann (Hrsg.): Demenzerkrankungen erkennen, behandeln und versorgen. Deutscher Ärzte-Verlag, Köln 2009, ISBN 978-3-7691-0563-6.
- 4Sabine Engel: Alzheimer und Demenzen. Unterstützung für Angehörige. Trias-Verlag, Stuttgart 2012, ISBN 978-3-8304-3983-7.
- 5R. Mahlberg, H. Gutzmann (Hrsg.): Demenzerkrankungen erkennen, behandeln und versorgen. Deutscher Ärzte-Verlag, Köln 2012, ISBN 978-3-7691-0563-6.
- 6Skript (Memento vom 21. September 2008 im Internet Archive) (PDF; 612 kB) der Sendung Quarks & Co zum Thema Alzheimer
- 7Alexandra Bröhm: Warum Frauen häufiger an Alzheimer erkranken. In: welt.de. Axel Springer SE, 31. Mai 2016, abgerufen am 30. Dezember 2019
- 8Jane Gilmore: A possible ‘link’ between menopause and Alzheimer’s is scaring women, including me. In: The Sydney Morning Herald. 7. Juni 2019, abgerufen am 30. Dezember 2019 (englisch).
- 9Deutsche Alzheimer Gesellschaft e. V.: Die Häufigkeit von Demenzerkrankungen. (PDF) Infoblatt 1. In: deutsche-alzheimer.de. Juni 2018, abgerufen am 9. August 2019.
- 10World Alzheimer Report 2015. The Global Impact of Dementia. (PDF) An analysis of prevalence, Incidence, cost and trends. Alzheimer’s Disease International (ADI), August 2015, abgerufen am 9. August 2019 (englisch).
- 11D. Kapl, K. A. Rudolphi: Neue pharmakologische Aspekte zum neurologischen Profil von Propentofyllin. In: Tierärztliche Praxis (26)(K), 1998, S. 317–321
- 12“Die Ursachen der Alzheimer-Krankheit sind bislang nicht vollständig geklärt. Die bisherige Forschung zeigt, dass an ihrer Entstehung mehrere Faktoren beteiligt sind.” In: Elisabeth Stechl, Catarina Knüvener et al.: Praxishandbuch Demenz. Erkennen – Verstehen – Behandeln. Mabuse-Verlag, Frankfurt am Main 2012, ISBN 978-3-86321-038-0., S. 192
- 13“Obgleich die Ätiologie der Alzheimer-Demenz letztlich weiterhin als ungeklärt bezeichnet werden muss, gab es doch in den letzten Jahren einen deutlichen Wissenszuwachs in der Pathologie der Erkrankung, in erster Linie auf der Basis von genetischen und molekularbiologischen Untersuchungen.” In: R. Mahlberg, H. Gutzmann (Hrsg.): Demenzerkrankungen erkennen, behandeln und versorgen. Deutscher Ärzte-Verlag, Köln 2009, ISBN 978-3-7691-0563-6., S. 11 f.
- 14J. J. Iliff et al.: Impairment of glymphatic pathway function promotes tau pathology after traumatic brain injury. In: The Journal of neuroscience: the official journal of the Society for Neuroscience. Band 34, Nr. 49, Dezember 2014, S. 16180–16193, doi:10.1523/JNEUROSCI.3020-14.2014, PMID 25471560, PMC 4252540 (freier Volltext).
- 15J. M. Tarasoff-Conway et al.: Clearance systems in the brain-implications for Alzheimer disease. In: Nature reviews. Neurology. Band 11, Nr. 8, August 2015, S. 457–470, doi:10.1038/nrneurol.2015.119, PMID 26195256, PMC 4694579 (freier Volltext) (Review).
- 16J. J. Iliff et al.: Impairment of glymphatic pathway function promotes tau pathology after traumatic brain injury. In: The Journal of neuroscience: the official journal of the Society for Neuroscience. Band 34, Nr. 49, Dezember 2014, S. 16180–16193, doi:10.1523/JNEUROSCI.3020-14.2014, PMID 25471560, PMC 4252540 (freier Volltext).
- 17
- 18T. Jonsson et al.: A mutation in APP protects against Alzheimer’s disease and age-related cognitive decline. In: Nature. Band 488, Nr. 7409, August 2012, S. 96–99, doi:10.1038/nature11283. PMID 22801501.
- 19E. Rogaeva et al.: The neuronal sortilin-related receptor SORL1 is genetically associated with Alzheimer disease. In: Nature genetics. Band 39, Nr. 2, Februar 2007, S. 168–177, doi:10.1038/ng1943. PMID 17220890. PMC 2657343 (freier Volltext).
- 20F. Lopera et al.: Clinical features of early-onset Alzheimer disease in a large kindred with an E280A presenilin-1 mutation. In: JAMA. Band 277, Nr. 10, März 1997, S. 793–799, PMID 9052708.
- 21Pam Belluck: Alzheimer’s Stalks a Colombian Family. In: nytimes.com. 1. Juni 2010, abgerufen am 27. Juli 2015 (englisch).
- 22PSEN1 E280A (Paisa). In: alzforum.org. Abgerufen am 27. Juli 2015 (englisch).
- 23Andreas Kleinschmidt: Alzheimer Früherkennung. In: siemens.com. 15. April 2013, abgerufen am 27. Juli 2015.
- 24. Panza et al.: Amyloid-based immunotherapy for Alzheimer’s disease in the time of prevention trials: the way forward. In: Expert review of clinical immunology. Band 10, Nr. 3, März 2014, S. 405–419, doi:10.1586/1744666X.2014.883921, PMID 24490853 (Review).
- 25F. Panza et al.: Is there still any hope for amyloid-based immunotherapy for Alzheimer’s disease? In: Current opinion in psychiatry. Band 27, Nr. 2, März 2014, S. 128–137, doi:10.1097/YCO.0000000000000041, PMID 24445401 (Review).
- 26
- 27Klinische Studie (Phase I): A Multiple Ascending Dose Study of COR388 bei Clinicaltrials.gov der NIH
- 28S. J. Soscia et al.: The Alzheimer’s disease-associated amyloid beta-protein is an antimicrobial peptide. In: PloS one. Band 5, Nr. 3, 2010, S. e9505, doi:10.1371/journal.pone.0009505. PMID 20209079. PMC 2831066 (freier Volltext).
- 29Stephen S. Dominy et al.: Porphyromonas gingivalis in Alzheimer’s disease brains: Evidence for disease causation and treatment with small-molecule inhibitors In: Science Advances. Band 5, Nr. 1, 2019,
- 30
- 31Klinische Studie (Phase I): A Multiple Ascending Dose Study of COR388 bei Clinicaltrials.gov der NIH
- 32Michiyo Iba, Jing L. Guo, Jennifer D. McBride, Bin Zhang, John Q. Trojanowski und Virginia M.-Y. Lee: Synthetic Tau Fibrils Mediate Transmission of Neurofibrillary Tangles in a Transgenic Mouse Model of Alzheimer’s-Like Tauopathy In: The Journal of Neuroscience. Nr. 33, 16. Januar 2013, S. 1024–1037.
- 33R. Mayeux, R. Ottman, M. Tang, L. Noboa-Bauza, K. Marder, B. Gurland, Y. Stern: Genetic susceptibility and head injury as risk factors for Alzheimer’s disease among community-dwelling elderly persons and their first-degree relatives. In: Ann Neurol. Band 33, Nr. 5, 1993, S. 494–501, PMID 8498827.
- 34K. F. Neumann, L. Rojo, L. P. Navarrete, G. Farías, P. Reyes, R. B. Maccioni: Insulin resistance and Alzheimer’s disease: molecular links & clinical implications. In: Curr Alzheimer Res.:. Nr. 5 (5), Oktober 2008, S. 438–447, PMID 18855585.
- 35J. S. Roriz-Filho, T. M. Sá-Roriz, I. Rosset, A. L. Camozzato, A. C. Santos, M. L. Chaves, J. C. Moriguti, M. Roriz-Cruz: (Pre)diabetes, brain aging, and cognition. In: Biochim Biophys Acta. 2009, S. 432–443, PMID 19135149.
- 36W. Q. Qiu, M. F. Folstein: Insulin, insulin-degrading enzyme and amyloid-beta peptide in Alzheimer’s disease: review and hypothesis. In: Neurobiol Aging. Feb; 27 (2), 2006, S. 190–198, PMID 19135149.
- 37O. S. Kofman, V. H. Macmillan: Diffuse cerebral atrophy. In: Applied therapeutics. Band 12, Nr. 4, April 1970, S. 24–26, PMID 5446326.
- 38M. Crisby, L. Carlson, B. Winblad: Statins in the prevention and treatment of Alzheimer disease. In: Alzheimer Disease & Associated Disorders. Band 16, Nr. 3, 2002, S. 131–136, PMID 12218642.
- 39P. Kehoe, G. Wilcock: Is inhibition of the renin-angiotensin system a new treatment option for Alzheimer’s disease? In: Lancet neurology. Band 6, Nr. 4, 2007, S. 373–378, PMID 17362841.
- 40„Why stroke ups Alzheimer’s risk“ BBC, vom 4. Juni 2007
- 41Nigel Hawkes: Alzheimers linked to aluminium pollution in tap water. In: The Times. 20. April 2006, abgerufen am 7. April 2010.
- 42Virginie Rondeau, Daniel Commenges, Hélène Jacqmin-Gadda, Jean-François Dartigues: Relation between Aluminum Concentrations in Drinking Water and Alzheimer’s Disease: An 8-year Follow-up Study. In: Am J Epidemiology. 2000, PMID 10901330 (Online).
- 43V. Rondeau, H. Jacqmin-Gadda, D. Commenges, C. Helmer, J.-F. Dartigues: Aluminum and Silica in Drinking Water and the Risk of Alzheimer’s Disease or Cognitive Decline: Findings From 15-Year Follow-up of the PAQUID Cohort. In: American Journal of Epidemiology. Band 169, Nr. 4, 2008, S. 489–496, doi:10.1093/aje/kwn348, PMID 19064650, PMC 2809081 (freier Volltext).
- 44Sakae Yumoto, Shigeo Kakimi, Akihiro Ohsaki, Akira Ishikawa: Demonstration of aluminum in amyloid fibers in the cores of senile plaques in the brains of patients with Alzheimer’s disease. In: Journal of Inorganic Biochemistry. Band 103, Nr. 11, 2009, S. 1579–84, doi:10.1016/j.jinorgbio.2009.07.023, PMID 19744735.
- 45P. C. Ferreira, A. Piai Kde, A. M. Takayanagui, S. I. Segura-Muñoz: Aluminum as a risk factor for Alzheimer’s disease. In: Rev Lat Am Enfermagem. Band 16, Nr. 1, 2008, S. 151–157, doi:10.1590/S0104-11692008000100023, PMID 18392545 (Online).
- 46Alzheimer’s Society: Aluminium and Alzheimer’s disease. (PDF) In: The Learning Exchange. Juni 2002, abgerufen am 9. August 2019 (englisch).
- 47Bundesinstituts für Risikobewertung: Keine Alzheimer-Gefahr durch Aluminium aus Bedarfsgegenständen (PDF; 8 Seiten, 65 kB), am 4. Oktober 2013.
- 48Bundesinstitut für Risikobewertung: Aluminiumhaltige Antitranspirantien tragen zur Aufnahme von Aluminium bei. (PDF; 15 Seiten), am 10. März 2014
- 49Lilian Calderón-Garcidueñas et al.: Hallmarks of Alzheimer disease are evolving relentlessly in Metropolitan Mexico City infants, children and young adults. APOE4 carriers have higher suicide risk and higher odds of reaching NFT stage V at ≤ 40 years of age. In: Environmental Research, 164, 2018, S. 475, doi:10.1016/j.envres.2018.03.023.
- 50Hirnleistungs-Check zur Früherkennung einer Demenz. IGeL-Monitor; abgerufen am 15. Januar 2019. Wichtigste Quellen darin: Meta-Analyse Tsoi 2016. – KK Tsoi, HW Hirai, JY Chan, TC. Kwok: Time to Treatment Initiation in People With Alzheimer Disease: A Meta-Analysis of Randomized Controlled Trials. In: Journal of the American Medical Directors Association, 2016, 17, S. 24–30, PMID 26392193; sowie Systematisches Review Lin et al. 2013 – J. S. Lin, E. O’Connor, R. C. Rossom, L. A. Perdue, E. Eckstrom: Screening for cognitive impairment in older adults: A systematic review for the U.S. Preventive Services Task Force. In: Annals of internal medicine, 2013, 159, S. 601–612, PMID 24354019. Mehr zur Begründung der Bewertung in Evidenz kompakt. (PDF) abgerufen am 15. Januar 2019.
- 51AWMF: S3-Leitlinie “Demenzen”. Abgerufen am 7. Januar 2021.
- 52MRT zur Früherkennung einer Alzheimer-Demenz. IGeL-Monitor; abgerufen am 15. Januar 2019. Wichtigste Quellen darin: NICE-Leitlinie von 2011. (National Institute for Health and Clinical Excellence der britischen Gesundheitsbehörde NHS) sowie Meta-Analyse Schmand et al. 2010. – B. Schmand, H. M. Huizenga, W. A. van Gool: Meta-analysis of CSF and MRI biomarkers for detecting preclinical Alzheimer’s disease. In: Psychological Medicine, Januar 2010, 40 (1): S. 135–145, PMID 19863841. Mehr zur Begründung der Bewertung in der Evidenzsynthese. (PDF) abgerufen am 15. Januar 2019.
- 53Artikel aus dem Tagesspiegel. vom 21. Februar 2018 oder aus der Ärzte-Zeitung. vom 5. Dezember 2017.
- 54G. B. Frisoni et al.: Revised criteria for Alzheimer’s disease: what are the lessons for clinicians? In: The Lancet. Neurology. Band 10, Nr. 7, Juli 2011, S. 598–601, doi:10.1016/S1474-4422(11)70126-0. PMID 21683925.
- 557 Stufen von Alzheimer | Deutschland. Abgerufen am 15. April 2021.
- 56R. T. Linn et al.: The ‘preclinical phase’ of probable Alzheimer’s disease. A 13-year prospective study of the Framingham cohort. In: Arch Neurol. Band 52, Nr. 5, 1995, S. 485–490, PMID 7733843.
- 57J. Saxton et al.: Preclinical Alzheimer disease: neuropsychological test performance 1.5 to 8 years prior to onset. In: Neurology. Band 63, Nr. 12, 2004, S. 2341–2347, PMID 15623697.
- 58E. W. Twamley, S. A. Ropacki, M. W. Bondi: Neuropsychological and neuroimaging changes in preclinical Alzheimer’s disease. In: J Int Neuropsychol Soc. Band 12, Nr. 5, 2006, S. 707–735, doi:10.1017/S1355617706060863, PMID 16961952.
- 59G. B. Frisoni et al.: Revised criteria for Alzheimer’s disease: what are the lessons for clinicians? In: The Lancet. Neurology. Band 10, Nr. 7, Juli 2011, S. 598–601, doi:10.1016/S1474-4422(11)70126-0. PMID 21683925.
- 60G. B. Frisoni et al.: Revised criteria for Alzheimer’s disease: what are the lessons for clinicians? In: The Lancet. Neurology. Band 10, Nr. 7, Juli 2011, S. 598–601, doi:10.1016/S1474-4422(11)70126-0. PMID 21683925.
- 61R. A. Sperling et al.: Toward defining the preclinical stages of Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. In: Alzheimer’s & dementia. Band 7, Nr. 3, Mai 2011, S. 280–292, doi:10.1016/j.jalz.2011.03.003. PMID 21514248. PMC 3220946 freier Volltext.
- 62M. S. Albert et al.: The diagnosis of mild cognitive impairment due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. In: Alzheimer’s & dementia: the journal of the Alzheimer’s Association. Band 7, Nr. 3, Mai 2011, S. 270–279, doi:10.1016/j.jalz.2011.03.008. PMID 21514249. PMC 3312027 (freier Volltext).
- 63G. M. McKhann et al.: The diagnosis of dementia due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. In: Alzheimer’s & dementia: the journal of the Alzheimer’s Association. Band 7, Nr. 3, Mai 2011, S. 263–269, doi:10.1016/j.jalz.2011.03.005. PMID 21514250. PMC 3312024 (freier Volltext).
- 64H.-J. Gertz, A. Kurz: Diagnose ohne Therapie. Frühdiagnostik der Alzheimer-Krankheit im Stadium der leichten kognitiven Beeinträchtigung. In: Der Nervenarzt. Band 82, Nr. 9, 2011, doi:10.1007/s00115-010-3213-3
- 65H. Barthel et al.: Cerebral amyloid-β PET with florbetaben (18F) in patients with Alzheimer’s disease and healthy controls: a multicentre phase 2 diagnostic study. In: The Lancet. Neurology. Band 10, Nr. 5, Mai 2011, S. 424–435, doi:10.1016/S1474-4422(11)70077-1. PMID 21481640.
- 66Nutzenbewertung von Arzneimitteln mit neuen Wirkstoffen nach § 35a SGB V – Florbetaben, Beschluss des G-BA “neue Untersuchungsmethode” vom 20. Februar 2014, abgerufen am 6. März 2014
- 67Thomas Hauser et al..: Mild cognitive impairment. Diagnostische Wertigkeit verschiedener MRT-Techniken. In: Der Radiologe. 2011; 51: S. 285–292 doi:10.1007/s00117-010-2094-6
- 68Marcus Bauser, Lutz Lehmann: Positronen-Emissions-Tomographie. In: Chemie in unserer Zeit. Band 46, Nr. 2, 2012, S. 94, doi:10.1002/ciuz.201200564.
- 69M. S. Albert et al.: The diagnosis of mild cognitive impairment due to Alzheimer’s disease: recommendations from the National Institute on Aging-Alzheimer’s Association workgroups on diagnostic guidelines for Alzheimer’s disease. In: Alzheimer’s & dementia: the journal of the Alzheimer’s Association. Band 7, Nr. 3, Mai 2011, S. 270–279, doi:10.1016/j.jalz.2011.03.008. PMID 21514249. PMC 3312027 (freier Volltext).
- 70L. Mucke: Neuroscience: Alzheimer’s disease. In: Nature. Band 461, 2009, S. 895–897, PMID 19829367.
- 71H. Förstl, A. Kurz: Clinical features of Alzheimer’s disease. In: European Archives of Psychiatry and Clinical Neuroscience. Band 249, Nr. 6, 1999, S. 288–290, PMID 10653284.
- 72G. A. Carlesimo, M. Oscar-Berman: Memory deficits in Alzheimer’s patients: a comprehensive review. In: Neuropsychology Review. Band 3, Nr. 2, 1992, S. 119–169, PMID 1300219.
- 73M. Jelicic, A. E. Bonebakker, B. Bonke: Implicit memory performance of patients with Alzheimer’s disease: a brief review. In: International psychogeriatrics / IPA. Band 7, Nr. 3, 1995, S. 385–392, PMID 8821346.
- 74E. M. Frank: Effect of Alzheimer’s disease on communication function. In: Journal of the South Carolina Medical Association (1975). Band 90, Nr. 9, 1994, S. 417–423, PMID 7967534.
- 75J. T. Becker, A. A. Overman: [The semantic memory deficit in Alzheimer’s disease]. In: Revista De Neurologia. Band 35, Nr. 8, 2002, S. 777–783, PMID 12402233.
- 76J. R. Hodges, K. Patterson: Is semantic memory consistently impaired early in the course of Alzheimer’s disease? Neuroanatomical and diagnostic implications. In: Neuropsychologia. Band 33, Nr. 4, 1995, S. 441–459, PMID 7617154.
- 77T. Benke: Two forms of apraxia in Alzheimer’s disease. In: Cortex; a Journal Devoted to the Study of the Nervous System and Behavior. Band 29, Nr. 4, 1993, S. 715–725, PMID 8124945.
- 78H. Förstl, A. Kurz: Clinical features of Alzheimer’s disease. In: European Archives of Psychiatry and Clinical Neuroscience. Band 249, Nr. 6, 1999, S. 288–290, PMID 10653284.
- 79Liz Kumru: Getting Lost in Alzheimer’s. UNMC; abgerufen am 22. Juli 2007 unmc.edu (Memento vom 10. Mai 2001 im Internet Archive)
- 80Tom Rickey: Road Skills Hint At “Motion Blindness” Of Alzheimer’s. University of Rochester Medical Center, 31. Januar 2002, abgerufen am 25. März 2016.
- 81Konzepte für Alzheimer-Impfungen im Testlabor. In: Deutsches Ärzteblatt. 9. November 2017, abgerufen am 9. August 2019.
- 82Antikörper löst Amyloid bei Alzheimer-Patienten.Ärzte Zeitung, 21. Mai 2010, abgerufen am 6. November 2010.
- 83rme/aerzteblatt.de: Alzheimer: Zweite Studie zur Antikörpertherapie abgebrochen. In: aerzteblatt.de. 7. August 2012, abgerufen am 27. Dezember 2014.
- 84Oliver Wirths et al.: Identification of low molecular weight pyroglutamate A{beta} oligomers in Alzheimer disease: a novel tool for therapy and diagnosis. In: The Journal of Biological Chemistry. Band 285, Nr. 53, 2010, S. 41517–41524, doi:10.1074/jbc.M110.178707, PMID 20971852, PMC 3009878 (freier Volltext)..
- 85Stefan Weller: Therapie gegen Alzheimer: Göttinger Forscher entwickeln neuen Ansatz für passive Immunisierung. Universitätsmedizin Göttingen – Georg-August-Universität, Pressemitteilung vom 5. November 2010 beim Informationsdienst Wissenschaft (idw-online.de), abgerufen am 6. November 2010.
- 86Gary W. Small: What we need to know about age related memory loss. In: British Medical Journal. 22. Juni 2002, abgerufen am 5. November 2006.
- 87M. Z. Scalco, R. van Reekum: Prevention of Alzheimer disease. Encouraging evidence. In: Canadian family physician Médecin de famille canadien. Band 52, Februar 2006, S. 200–207, PMID 16529393. PMC 1479722 (freier Volltext). (Review).
- 88Sam Norton et al.: Potential for primary prevention of Alzheimer’s disease: an analysis of population-based data. In: The Lancet Neurology. Band 13, Nr. 8, 2014, S. 788–794, doi:10.1016/S1474-4422(14)70136-X (Online).
- 89K. A. Ginis et al.: Formulation of evidence-based messages to promote the use of physical activity to prevent and manage Alzheimer’s disease. In: BMC Public Health. Band 17, Nr. 1, Februar 2017, S. 209, doi:10.1186/s12889-017-4090-5, PMID 28212648, PMC 5316179 (freier Volltext).
- 90Äpfel fürs Hirn. Auf: wissenschaft.de vom 19. November 2004.
- 91Mit Fischöl gegen das Vergessen. Auf: wissenschaft.de vom 2. September 2004.
- 92M. Morris, J. Schneider, C. Tangney: Thoughts on B-vitamins and dementia. In: J Alzheimers Dis. Band 9, Nr. 4, 2006, S. 429–433, PMID 16917152.
- 93Inna I. Kruman et al.: Folic Acid Deficiency and Homocysteine Impair DNA Repair in Hippocampal Neurons and Sensitize Them to Amyloid Toxicity in Experimental Models of Alzheimer’s Disease. In: The Journal of Neuroscience. Band 22, Nr. 5, 1. März 2002, PMID 11880504. Einen vereinfachten Bericht findet man hier: www.alzheimers.org.uk
- 94Folate May Lower Alzheimer’s Risk In: CBS news, reporting from WebMD.
- 95NIH Press Release: Folic Acid Possibly A Key Factor In Alzheimer’s Disease Prevention. (Nicht mehr online verfügbar.) In: nih.gov. 3. Januar 2002, archiviert vom Original am 24. Juni 2014; abgerufen am 29. Dezember 2019.
- 96Kathleen Fackelmann: USATODAY.com – Folate shows promise in preventing Alzheimer’s. In: usatoday.com. 14. August 2005, abgerufen am 27. Dezember 2014.
- 97Raucher-Ausrede widerlegt. Auf: wissenschaft.de vom 8. Februar 2005.
- 98D. E. Zylberstein et al.: Midlife homocysteine and late-life dementia in women. A prospective population study. In: Neurobiology of aging. Band 32, Nr. 3, März 2011, S. 380–386, doi:10.1016/j.neurobiolaging.2009.02.024. PMID 19342123.
- 99A. D. Smith et al.: Homocysteine-lowering by B vitamins slows the rate of accelerated brain atrophy in mild cognitive impairment: a randomized controlled trial. In: PloS one. Band 5, Nr. 9, 2010, S. e12244, doi:10.1371/journal.pone.0012244. PMID 20838622. PMC 2935890 (freier Volltext).
- 100G. Douaud et al.: Preventing Alzheimer’s disease-related gray matter atrophy by B-vitamin treatment. In: Proceedings of the National Academy of Sciences. Band 110, Nr. 23, Juni 2013, S. 9523–9528, doi:10.1073/pnas.1301816110. PMID 23690582. PMC 3677457 (freier Volltext).
- 101Die Wunderwaffe gegen Alzheimer. In: vitamin-b12-mangel.org. Juli 2013, abgerufen am 27. Dezember 2014.
- 102Andrea Gerlin: Vitamins That Cost Pennies a Day Seen Delaying Dementia – Businessweek. In: businessweek.com. 20. Mai 2013, abgerufen am 27. Dezember 2014.
- 103Education May Not Protect Against Dementia as Previously Thought. Rush University, 6. Februar 2019, abgerufen am 9. August 2019 (englisch).
- 104Roy Eccleston: Think or sink. (PDF) (Nicht mehr online verfügbar.) In: The Weekend Australian Magazine. 2. Dezember 2006, archiviert vom Original am 23. Juli 2008; abgerufen am 3. Januar 2009.
- 105Kreuzworträtsel lösen reicht nicht. (Nicht mehr online verfügbar.) In: GesundheitPro.de. 8. November 2007, archiviert vom Original am 10. Juli 2009; abgerufen am 3. Januar 2009.
- 106Blutdruck senkende Mittel können Demenz vorbeugen. wissenschaft.de, 14. Oktober 2002.
- 107A. Brüning: Wie Cholesterin das Risiko für Alzheimer erhöht. In: Berliner Zeitung, 11. Oktober 2005.
- 108Berliner Zeitung, 24. Oktober 2013, S. 12.
- 109J. P. Guo, S. Yu, PL. McGeer: Simple in vitro assays to identify amyloid-beta aggregation blockers for Alzheimer’s disease therapy. In: J Alzheimers Dis. Band 19, Nr. 4, 2010, S. 1359–1370, PMID 20061605.
- 110S, Abbas, M. Mink: Epigallocatechin gallate inhibits beta amyloid oligomerization in Caenorhabditis elegans and affects the daf-2/insulin-like signaling pathway. In: J Alzheimers Dis. Band 17, Nr. 11, 2010, S. 902–909, PMID 20382008.
- 111D. E. Ehrnhoefer et al.: EGCG redirects amyloidogenic polypeptides into unstructured, off-pathway oligomers. In: Nat Struct Mol Biol. Band 15, Nr. 5, Juni 2008, S. 558–566, PMID 18511942.
- 112J. Bieschke et al.: EGCG remodels mature α-synuclein and amyloid-β fibrils and reduces cellular toxicity. In: Proc Natl Acad Sci USA. Band 107, Nr. 17, April 2010, PMID 20385841.
- 113F. Meng et al.: The flavanol (–)-epigallocatechin 3-gallate inhibits amyloid formation by islet amyloid polypeptide, disaggregates amyloid fibrils, and protects cultured cells against IAPP-induced toxicity. In: Biochemistry. Band 49, Nr. 37, September 2010, PMID 20707388.
- 114K. Rezai-Zadeh et al.: Green tea epigallocatechin-3-gallate (EGCG) reduces beta-amyloid mediated cognitive impairment and modulates tau pathology in Alzheimer transgenic mice. In: Brain Res. Band 12, Nr. 1214, Juni 2008, S. 177–186, PMID 18457818.
- 115
- 116G. Grelle et al.: Black Tea Theaflavins Inhibit Formation of Toxic Amyloid-β and α-Synuclein Fibrils. In: Biochemistry. November 2011, PMID 22054421.
- 117P. E. Cramer et al.: ApoE-directed therapeutics rapidly clear β-amyloid and reverse deficits in AD mouse models. In: Science. Band 335, Nr. 6075, März 2012, S. 1503–1506, doi:10.1126/science.1217697. PMID 22323736. PMC 3651582 (freier Volltext).
- 118Jessica Studeny: Drug quickly reverses Alzheimer’s symptoms in mice. Veröffentlichung der Case Western Reserve University, 9. Februar 2012.
- 119Drug Quickly Reverses Alzheimer’s Symptoms in Mice. Meldung bei Neurosciencenews.com vom 10. Februar 2012.
- 120Harald Frater: Krebsmedikament macht Alzheimer-Symptome rückgängig: Wirkstoff Bexaroten beseitigt Gedächtnisstörungen und Eiweiß-Plaques bei Mäusen. In: g-o.de. 10. Februar 2012, abgerufen am 27. Dezember 2014.
- 121E. O’Hare et al.: Lack of support for bexarotene as a treatment for Alzheimer’s disease. In: Neuropharmacology. [elektronische Veröffentlichung vor dem Druck] Mai 2015, doi:10.1016/j.neuropharm.2015.04.020, PMID 26025659.
- 122C. Balducci et al.: The Continuing Failure of Bexarotene in Alzheimer’s Disease Mice. In: Journal of Alzheimer’s disease: JAD. [elektronische Veröffentlichung vor dem Druck] März 2015, doi:10.3233/JAD-150029, PMID 25777514.
- 123B. Tousi: The emerging role of bexarotene in the treatment of Alzheimer’s disease: current evidence. In: Neuropsychiatric disease and treatment. Band 11, 2015, S. 311–315, doi:10.2147/NDT.S61309, PMID 25709453, PMC 4327563 (freier Volltext) (Review).
- 124Weblink für Paper Paul T. Francis, Gordon K. Wilcock et al.: The cholinergic hypothesis of Alzheimer’s disease: a review of progress In: J Neurol Neurosurg Psychiatry (1999)
- 125Huperzine A Alzheimer Research Forum
- 126B. S. Wang, H. Wang, Z. H. Wei, Y. Y. Song, L. Zhang, H. Z. Chen: Efficacy and safety of natural acetylcholinesterase inhibitor huperzine A in the treatment of Alzheimer’s disease: an updated meta-analysis. In: Journal of Neural Transmission. Band 116, Nr. 4, 2009, S. 457–465, doi:10.1007/s00702-009-0189-x, PMID 19221692.
- 127B. Winblad, J. Cummings, N. Andreasen et al.: A six-month double-blind, randomized, placebo-controlled study of a transdermal patch in Alzheimer’s disease – rivastigmine patch versus capsule. In: International Journal of Geriatric Psychiatry, Band 22, Nr. 5, S. 456–467, May 2007 doi:10.1002/gps.1788 PMID 17380489
- 128H. Kaduszkiewicz, T. Zimmermann, H. P. Beck-Bornholdt, Hendrik van den Bussche: Cholinesterase inhibitors for patients with Alzheimer’s disease: systematic review of randomised clinical trials. In: BMJ (Clinical Research Ed.). Band 331, Nr. 7512, August 2005, S. 321–327, PMID 16081444, PMC 1183129 (freier Volltext).
- 129T. Lempert, T. Bschor: [Treatment of Alzheimer’s disease according to the S3 guidelines on dementia. Choline esterase inhibitors for all and for ever?]. In: Der Nervenarzt. Band 82, Nr. 1, Januar 2011, S. 90–91, doi:10.1007/s00115-010-3233-z. PMID 21274696.
- 130J. C. Breitner, K. A. Welsh et al.: Delayed onset of Alzheimer’s disease with nonsteroidal anti-inflammatory and histamine H2 blocking drugs. In: Neurobiology of Aging Volume 16, Issue 4, Pages 523-530, July 1995 PMID 8544901
- 131T. Wyss-Coray, L. Mucke: Ibuprofen, inflammation and Alzheimer disease. In: Nature medicine. Band 6, Nr. 9, September 2000, S. 973–974, doi:10.1038/79661. PMID 10973311.
- 132D. Dokmeci: Ibuprofen and Alzheimer’s disease. In: Folia medica. Band 46, Nr. 2, 2004, S. 5–10, PMID 15506544. (Review).
- 133T. Morihara et al.: Ibuprofen suppresses interleukin-1beta induction of pro-amyloidogenic alpha1-antichymotrypsin to ameliorate beta-amyloid (Abeta) pathology in Alzheimer’s models. In: Neuropsychopharmacology: official publication of the American College of Neuropsychopharmacology. Band 30, Nr. 6, Juni 2005, S. 1111–1120, doi:10.1038/sj.npp.1300668. PMID 15688088.
- 134A. C. McKee et al.: Ibuprofen reduces Abeta, hyperphosphorylated tau and memory deficits in Alzheimer mice. In: Brain research. Band 1207, Mai 2008, S. 225–236, doi:10.1016/j.brainres.2008.01.095. PMID 18374906. PMC 2587244 (freier Volltext).
- 135M. Sastre et al.: Nonsteroidal anti-inflammatory drugs repress beta-secretase gene promoter activity by the activation of PPARgamma. In: Proceedings of the National Academy of Sciences. Band 103, Nr. 2, Januar 2006, S. 443–448, doi:10.1073/pnas.0503839103. PMID 16407166. PMC 1326151 (freier Volltext)./mfn] Beim Menschen liegen bisher keine Daten aus randomisierten Doppelblind-Studien vor, die eine gesicherte Wirkungsweise von Ibuprofen und anderen nichtsteroidalen Antirheumatika aufzeigen. Aufgrund der nicht unerheblichen Nebenwirkungen, die bei einer dauerhaften prophylaktischen Einnahme von Ibuprofen zu erwarten sind, wird von einer unkontrollierten Einnahme abgeraten.135N. Tabet, H. Feldmand: Ibuprofen for Alzheimer’s disease. In: The Cochrane database of systematic reviews. Nr. 2, 2003, S. CD004031, doi:10.1002/14651858.CD004031. PMID 12804498. (Review).
- 136B. De Strooper, G. König: An inflammatory drug prospect. In: Nature. Band 414, Nr. 6860, November 2001, S. 159–160, doi:10.1038/35102656. PMID 11700538.
- 137Gregor Larbig: Studien zur Identifizierung & Optimierung potentieller Wirkstoffe für die Behandlung von Morbus Alzheimer. Dissertation, TU Darmstadt, 2007
- 138T. Müller: Neue Wege gegen das Amyloid im Hirn. In: Ärzte Zeitung am 7. Dezember 2007
- 139M. Krohn et al.: Cerebral amyloid-β proteostasis is regulated by the membrane transport protein ABCC1 in mice. In: The Journal of clinical investigation. Band 121, Nr. 10, Oktober 2011, S. 3924–3931, doi:10.1172/JCI57867. PMID 21881209. PMC 3195473 (freier Volltext).
- 140R. McShane, A. Areosa Sastre, N. Minakaran: Memantine for dementia. In: The Cochrane database of systematic reviews. Nr. 2, 2006, S. CD003154, doi:10.1002/14651858.CD003154.pub5. PMID 16625572. (Review).
- 141J. Birks, Evans J. Grimley: Ginkgo biloba for cognitive impairment and dementia. In: Cochrane Database Syst Rev. Nr. 2, 2007, S. CD003120, doi:10.1002/14651858.CD003120.pub2, PMID 17443523
- 142J. Birks, E. Grimley, M. Van Dongen: Ginkgo biloba for cognitive impairment and dementia. In: Cochrane Database Syst Rev. S. CD003120, PMID 12519586.
- 143S. T. DeKosky, A. Fitzpatrick, D. G. Ives, J. Saxton, J. Williamson, O. L. Lopez, G. Burke, L. Fried, L. H. Kuller, J. Robbins, R. Tracy, N. Woolard, L. Dunn, R. Kronmal, R. Nahin, C. Furberg: The Ginkgo Evaluation of Memory (GEM) study: design and baseline data of a randomized trial of Ginkgo biloba extract in prevention of dementia. In: Contemp Clin Trials. Band 27, Nr. 3, 2006, S. 238–253, doi:10.1016/j.cct.2006.02.007, PMID 16627007.
- 144Ginkgo Biloba Does Not Reduce Dementia Risk, Study Shows. In: sciencedaily.com. 19. November 2008, abgerufen am 27. Dezember 2014.
- 145B. E. Snitz et al.: Ginkgo biloba for preventing cognitive decline in older adults: a randomized trial. In: JAMA. Band 302, Nr. 24, Dezember 2009, S. 2663–2670, doi:10.1001/jama.2009.1913. PMID 20040554. PMC 2832285 (freier Volltext).
- 146Stefan Weinmann et al.: Effects of Ginkgo biloba in dementia: systematic review and meta-analysis. In: BMC Geriatrics 2010, 10:14 doi:10.1186/1471-2318-10-14
- 147
- 148B. Kastenholz: Phytopharmaceuticals in the therapy of younger Alzheimer patients. WebmedCentral AGING 2011; 2 (7): WMC002011.
- 149S. Krishnan, R. Cairns, R. Howard: Cannabinoids for the treatment of dementia. In: The Cochrane database of systematic reviews. Nr. 2, 2009, S. CD007204, doi:10.1002/14651858.CD007204.pub2, PMID 19370677 (Review).
- 150S. Craft et al.: Intranasal insulin therapy for Alzheimer disease and amnestic mild cognitive impairment: a pilot clinical trial. In: Archives of neurology. Band 69, Nr. 1, Januar 2012, S. 29–38, doi:10.1001/archneurol.2011.233. PMID 21911655. PMC 3260944 (freier Volltext).
- 151M. W. Dysken et al.: Effect of vitamin E and memantine on functional decline in Alzheimer disease: the TEAM-AD VA cooperative randomized trial. In: JAMA. Band 311, Nr. 1, Januar 2014, S. 33–44, doi:10.1001/jama.2013.282834. PMID 24381967. PMC 4109898 (freier Volltext).
- 152M. Sano et al.: A controlled trial of selegiline, alpha-tocopherol, or both as treatment for Alzheimer’s disease. The Alzheimer’s Disease Cooperative Study. In: The New England Journal of Medicine. Band 336, Nr. 17, April 1997, S. 1216–1222, doi:10.1056/NEJM199704243361704. PMID 9110909.
- 153R. C. Petersen et al.: Vitamin E and donepezil for the treatment of mild cognitive impairment. In: The New England Journal of Medicine. Band 352, Nr. 23, Juni 2005, S. 2379–2388, doi:10.1056/NEJMoa050151. PMID 15829527.
- 154J. H. Kang et al.: A randomized trial of vitamin E supplementation and cognitive function in women. In: Archives of internal medicine. Band 166, Nr. 22, 2006 Dec 11-25, S. 2462–2468, doi:10.1001/archinte.166.22.2462. PMID 17159011.
- 155J. H. Kang et al.: Vitamin E, vitamin C, beta carotene, and cognitive function among women with or at risk of cardiovascular disease: The Women’s Antioxidant and Cardiovascular Study. In: Circulation. Band 119, Nr. 21, Juni 2009, S. 2772–2780, doi:10.1161/CIRCULATIONAHA.108.816900. PMID 19451353. PMC 2752297 (freier Volltext).
- 156E. R. Miller et al.: Meta-analysis: high-dosage vitamin E supplementation may increase all-cause mortality. In: Annals of internal medicine. Band 142, Nr. 1, Januar 2005, S. 37–46, PMID 15537682.
- 157Hilkka Soininen et al.: 24-month intervention with a specific multinutrient in people with prodromal Alzheimer’s disease (LipiDiDiet): a randomised, double-blind, controlled trial. In: The Lancet Neurology. Band 0, Nr. 0, ISSN 1474-4422, doi:10.1016/S1474-4422(17)30332-0 (Online ,abgerufen am 11. November 2017).
- 158Ärzte Zeitung: Europäische Studie: Hilft Nährstoff-Kombi bei Alzheimer im Frühstadium? Abgerufen am 11. November 2017.
- 159J. Cohen-Mansfield: Nonpharmacologic interventions for inappropriate behaviors in dementia: a review, summary, and critique. In: Am J Geriatr Psychiatry. 9 (4), 2001, S. 361–381. PMID 11739063 (Review)
- 160
- 161L. E. Middleton et al.: Activity energy expenditure and incident cognitive impairment in older adults. In: Archives of internal medicine. Band 171, Nr. 14, Juli 2011, S. 1251–1257, doi:10.1001/archinternmed.2011.277. PMID 21771893. PMC 3923462 (freier Volltext).
- 162M. N. Vercambre et al.: Physical activity and cognition in women with vascular conditions. In: Archives of internal medicine. Band 171, Nr. 14, Juli 2011, S. 1244–1250, doi:10.1001/archinternmed.2011.282. PMID 21771894. PMC 3153432 (freier Volltext).
- 163T. E. Dunne, S. A. Neargarder, P. B. Cipolloni, A. Cronin-Golomb: Visual contrast enhances food and liquid intake in advanced Alzheimer’s disease. In: Clin Nutr. Band 23, Nr. 4, 2004, S. 533–538, PMID 15297089.
- 164S3-Leitlinie Demenzen. 2017, doi:10.1007/978-3-662-53875-3.
- 165A. Alzheimer: Über eine eigenartige Erkrankung der Hirnrinde. In: Allg. Z. Psychiat. Psych.-Gerichtl. Med. Band 64, Nr. 1–2, 1907, S. 146–148.
- 166Konrad Maurer, Ulrike Maurer: Alzheimer: the life of a physician and the career of a disease. Columbia University Press, New York 2003.
- 167Fred H. Hochberg, David Rottenberg: Neurological classics in modern translation. Hafner Press, New York 1977, ISBN 0-02-851180-8.
- 168N. C. Berchtold, C. W. Cotman: Evolution in the conceptualization of dementia and Alzheimer’s disease: Greco-Roman period to the 1960s. In: Neurobiol. Aging. Band 19, Nr. 3, 1998, S. 173–189, PMID 9661992.
- 169Emil Kraepelin: Textbook of Psychiatry. 1910.
- 170M. B. Graeber et al.: Rediscovery of the case described by Alois Alzheimer in 1911: historical, histological and molecular genetic analysis. In: Neurogenetics. Band 1, Nr. 1, Mai 1997, S. 73–80, PMID 10735278.
- 171U. Müller, P. Winter, M. B. Graeber: A presenilin 1 mutation in the first case of Alzheimer’s disease. In: The Lancet. Neurology. Band 12, Nr. 2, Februar 2013, S. 129–130, doi:10.1016/S1474-4422(12)70307-1. PMID 23246540.
- 172Preisgekrönte Filmbiographie Iris von 2001. Darin wird die Geschichte ihres Verfalls aus der Sicht ihres Mannes John Bayley beschrieben. Murdoch wurde von Kate Winslet und Judi Dench dargestellt.
- 173Jochen Wittmann: Pratchetts “Choosing to die: Selbstmord zur besten Sendezeit. In: derstandard.at. 15. Juni 2011, abgerufen am 27. Dezember 2014.
- 174Tilman Jens: Vaters Vergessen. In: FAZ.net. 4. März 2008, abgerufen am 27. Dezember 2014.
- 175Paul Wolff: Von der Leyen und die Krankheit ihres Vaters. In: welt.de. 27. Mai 2008, abgerufen am 27. Dezember 2014.
- 176Zum Beispiel Titelthema in Die Zeit, 12. Mai 2011: Die Angst vor Alzheimer
- 177Gabriel García Márquez: Literaturnobelpreisträger leidet an Demenz. In: Spiegel Online. 8. Juli 2012, abgerufen am 27. Dezember 2014.
- 178Bitter irony of Alzheimer’s for Nobel laureate Marquez as his symptoms mimic masterpiece.
- 179Gerd Müller wird 70. In: fcbayern.de. 6. Oktober 2015, abgerufen am 6. Oktober 2015.
- 180DHPV-Ehrenpreis an Arno Geiger auf www.dhpv.de, 10. Oktober 2011
- 181Aus dem Schatten treten – Warum ich mich für unsere Rechte als Demenzbetroffene einsetze von Helga Rohra auf www.demenz-support.de
- 182Ralph Trommer: Meister der leisen Töne. In: taz.de. 4. November 2013, abgerufen am 27. Dezember 2014.
- 183Michela Farabella: Italo, con te partirò. Hrsg.: Carello Edizioni. Turin 2019, ISBN 978-88-96864-81-4, S. 144.
- 184
- 185Interview mit Regisseurin Barbara Wachendorff. In: Sommerblut – Festival der Multipolarkultur. 7. Mai 2012, abgerufen am 9. August 2019.
- 186
- 187Eines Tages… Offizielle Homepage zum Spielfilm
- 188DVD-Box Demenz. In: LVR-Klinikverbund. Landschaftsverband Rheinland (LVR), abgerufen am 9. August 2019.
- 189Von Johan Dehoust: Maxim Gorki Theater: Stuhlkreis mit Kater. In: Spiegel Online. 2. Januar 2013, abgerufen am 27. Dezember 2014.
- 190Thomas Liesen (Buch und Regie), Ulrike Schweitzer (Redaktion): Leben, Lieben, Vergessen… Längengrad-Filmproduktion, 2013 Online bei YouTube.
- 191Filmdrama “Still Alice”, Infos und Bewertung auf score11.de, abgerufen am 12. September 2015.
- 192
- 193Belastung der Gesundheitssysteme und der Volkswirtschaft durch Alzheimer (PDF) In: Medical Tribune, 36/2009
Hauptquellen der Texte und Materialien:
Internationale Wikipedias. Wurde evtl. ganz oder teilweise ins Deutsche übersetzt. Unter der Creative Commons Attribution-Share-Alike License 4.0 verfügbar; zusätzliche Bedingungen können gelten. Durch die Nutzung dieser Website erklären Sie sich mit den Nutzungsbedingungen und der Datenschutzrichtlinie einverstanden.
Weitere extensive und evtl. aktuellere Ausführungen finden Sie in den zitierten Wikipedia-Artikeln.