„Der Toll-like-Rezeptor 5, auch TLR5 genannt, ist ein Protein, das beim Menschen durch das TLR5-Gen kodiert wird,1Rock FL, Hardiman G, Timans JC, Kastelein RA, Bazan JF (January 1998). “A family of human receptors structurally related to Drosophila Toll”. Proceedings of the National Academy of Sciences of the United States of America. 95 (2): 588–93. Bibcode:1998PNAS…95..588R. doi:10.1073/pnas.95.2.588. PMC 18464. PMID 9435236. und gehört zur Familie der Toll-like-Rezeptoren (TLR). Es ist bekannt, dass TLR5 bakterielles Flagellin von eindringenden mobilen Bakterien erkennt.2Miao EA, Andersen-Nissen E, Warren SE, Aderem A (September 2007). “TLR5 and Ipaf: dual sensors of bacterial flagellin in the innate immune system”. Seminars in Immunopathology. 29 (3): 275–88. doi:10.1007/s00281-007-0078-z. PMID 17690885. S2CID 21209470. Es hat sich gezeigt, dass es an der Entstehung vieler Krankheiten beteiligt ist, darunter entzündliche Darmerkrankungen.3Stanislawowski M, Wierzbicki PM, Golab A, Adrych K, Kartanowicz D, Wypych J, et al. (October 2009). “Decreased Toll-like receptor-5 (TLR-5) expression in the mucosa of ulcerative colitis patients”. Journal of Physiology and Pharmacology. 60 Suppl 4: 71–5. PMID 20083854. Jüngste Studien haben auch gezeigt, dass eine Fehlfunktion von TLR5 wahrscheinlich mit rheumatoider Arthritis,4Kim SJ, Chen Z, Chamberlain ND, Essani AB, Volin MV, Amin MA, Volkov S, Gravallese EM, Arami S, Swedler W, Lane NE, Mehta A, Sweiss N, Shahrara S (October 2014). “Ligation of TLR5 promotes myeloid cell infiltration and differentiation into mature osteoclasts in rheumatoid arthritis and experimental arthritis”. Journal of Immunology. Baltimore, Md. 193 (8): 3902–13. doi:10.4049/jimmunol.1302998. PMC 4185216. PMID 25200955.5Badr MT, Häcker G (2019). “Gene expression profiling meta-analysis reveals novel gene signatures and pathways shared between tuberculosis and rheumatoid arthritis”. PLOS ONE. 14 (3): e0213470. doi:10.1371/journal.pone.0213470. PMC 6405138. PMID 30845171. Osteoklastogenese und Knochenschwund zusammenhängt.6Kassem A, Henning P, Kindlund B, Lindholm C, Lerner UH (November 2015). “TLR5, a novel mediator of innate immunity-induced osteoclastogenesis and bone loss”. FASEB Journal. 29 (11): 4449–60. doi:10.1096/fj.15-272559. PMID 26207027. Eine abnorme Funktion von TLR5 wird mit der Entstehung von Magen-, Gebärmutterhals-, Endometrium- und Eierstockkrebs in Verbindung gebracht.7Castaño-Rodríguez N, Kaakoush NO, Mitchell HM (2014-01-01). “Pattern-recognition receptors and gastric cancer”. Frontiers in Immunology. 5: 336. doi:10.3389/fimmu.2014.00336. PMC 4105827. PMID 25101079.8Husseinzadeh N, Davenport SM (November 2014). “Role of toll-like receptors in cervical, endometrial and ovarian cancers: a review”. Gynecologic Oncology. 135 (2): 359–63. doi:10.1016/j.ygyno.2014.08.013. PMID 25135000.
Funktion
Die TLR-Familie spielt eine grundlegende Rolle bei der Erkennung von Krankheitserregern und der Aktivierung der angeborenen Immunität. TLRs sind von Drosophila bis zum Menschen hoch konserviert und weisen strukturelle und funktionelle Ähnlichkeiten auf. Sie erkennen pathogen-assoziierte molekulare Muster (PAMPs), die auf Infektionserregern exprimiert werden, und vermitteln die Produktion von Zytokinen, die für die Entwicklung einer wirksamen Immunität notwendig sind. Die verschiedenen TLRs weisen unterschiedliche Expressionsmuster auf. TLR5 wird sowohl auf Immun- als auch auf Nicht-Immunzellen exprimiert9Sharma N, Akhade AS, Qadri A (April 2013). “Sphingosine-1-phosphate suppresses TLR-induced CXCL8 secretion from human T cells”. Journal of Leukocyte Biology. 93 (4): 521–8. doi:10.1189/jlb.0712328. PMID 23345392. und erkennt bakterielles Flagellin, einen Hauptbestandteil der bakteriellen Geißeln und einen Virulenzfaktor. Die Aktivierung dieses Rezeptors mobilisiert den Kernfaktor NF-κB und stimuliert die Produktion von Tumornekrosefaktor-alpha10“Entrez Gene: TLR5 toll-like receptor 5”..
TLR5 erkennt Flagellin,11Hayashi F, Smith KD, Ozinsky A, Hawn TR, Yi EC, Goodlett DR, et al. (April 2001). “The innate immune response to bacterial flagellin is mediated by Toll-like receptor 5”. Nature. 410 (6832): 1099–103. Bibcode:2001Natur.410.1099H. doi:10.1038/35074106. PMID 11323673. S2CID 4422702. das Proteinmonomer, aus dem das Filament der bakteriellen Geißeln besteht und das auf fast allen beweglichen Bakterien zu finden ist. Das Flagellinprotein weist bei allen Bakterien hoch konservierte Regionen auf, die die Erkennung von Flagellin durch einen in der Keimbahn kodierten Rezeptor wie TLR5 erleichtern.12Smith KD, Andersen-Nissen E, Hayashi F, Strobe K, Bergman MA, Barrett SL, et al. (December 2003). “Toll-like receptor 5 recognizes a conserved site on flagellin required for protofilament formation and bacterial motility”. Nature Immunology. 4 (12): 1247–53. doi:10.1038/ni1011. PMID 14625549. S2CID 6157006. Einige Flagellen von Proteobakterien haben jedoch Mutationen erworben, die ihre Erkennung durch TLR5 verhindern.13Andersen-Nissen E, Smith KD, Strobe KL, Barrett SL, Cookson BT, Logan SM, Aderem A (June 2005). “Evasion of Toll-like receptor 5 by flagellated bacteria”. Proceedings of the National Academy of Sciences of the United States of America. 102 (26): 9247–52. Bibcode:2005PNAS..102.9247A. doi:10.1073/pnas.0502040102. PMC 1166605. PMID 15956202.
Signalweg und Regulierung
Die TLR5-Signalkaskade wird in der Regel durch die Bindung der bakteriellen Geißel an TLR5 auf der Zelloberfläche ausgelöst. Die Bindung der Geißel führt zur Dimerisierung von TLR5, der wiederum MyD8814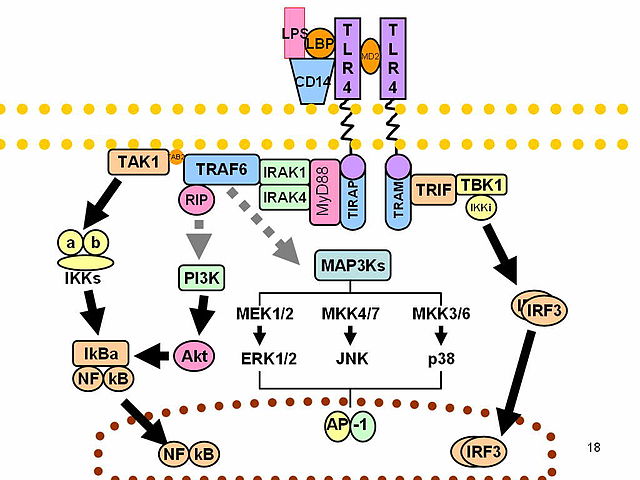
Myeloid differentiation primary response 88 (MYD88) is a protein that, in humans, is encoded by the MYD88 gene.
und Mal/TIRAP rekrutiert.15Gewirtz AT, Navas TA, Lyons S, Godowski PJ, Madara JL (August 2001). “Cutting edge: bacterial flagellin activates basolaterally expressed TLR5 to induce epithelial proinflammatory gene expression”. Journal of Immunology. 167 (4): 1882–5. doi:10.4049/jimmunol.167.4.1882. PMID 11489966. S2CID 23844864.16Choi YJ, Jung J, Chung HK, Im E, Rhee SH (January 2013). “PTEN regulates TLR5-induced intestinal inflammation by controlling Mal/TIRAP recruitment”. FASEB Journal. 27 (1): 243–54. doi:10.1096/fj.12-217596. PMC 3528317. PMID 23038756.17Rhee SH, Kim H, Moyer MP, Pothoulakis C (July 2006). “Role of MyD88 in phosphatidylinositol 3-kinase activation by flagellin/toll-like receptor 5 engagement in colonic epithelial cells”. The Journal of Biological Chemistry. 281 (27): 18560–8. doi:10.1074/jbc.M513861200. PMID 16644730. Die Rekrutierung von MyD88 führt zur anschließenden Aktivierung von IRAK418
IRAK-4 gehört zur IRAK-Familie und ist eine Proteinkinase, die an der Signalisierung angeborener Immunreaktionen durch Toll-like-Rezeptoren beteiligt ist. Sie unterstützt auch die Signalübertragung durch T-Zell-Rezeptoren. IRAK4 enthält Domänenstrukturen, die denen von IRAK1, IRAK2, IRAKM und Pelle ähnlich sind. IRAK4 ist im Vergleich zu IRAK1, IRAK2 und IRAKM insofern einzigartig, als es stromaufwärts von den anderen IRAKs funktioniert, aber in dieser Eigenschaft Pelle ähnlicher ist. IRAK4 hat wichtige klinische Anwendungen. Tiere ohne IRAK4 sind anfälliger für Viren und Bakterien, aber völlig resistent gegen LPS. , IRAK119
Die Interleukin-1-Rezeptor-assoziierte Kinase 1 (IRAK-1) ist ein Enzym, das beim Menschen durch das IRAK1-Gen kodiert wird. IRAK-1 spielt eine wichtige Rolle bei der Regulierung der Expression von Entzündungsgenen durch Immunzellen wie Monozyten und Makrophagen, die wiederum das Immunsystem bei der Beseitigung von Bakterien, Viren und anderen Krankheitserregern unterstützen. IRAK-1 gehört zur IRAK-Familie, die aus IRAK-1, IRAK-2, IRAK-3 und IRAK-4 besteht, und wird durch Entzündungsmoleküle aktiviert, die während eines pathogenen Angriffs durch Signalwege freigesetzt werden. IRAK-1 wird als ein Kinase-Enzym eingestuft, das Wege sowohl im angeborenen als auch im adaptiven Immunsystem reguliert., TRAF6 und schließlich der IκB-Kinasen.20Gohda J, Matsumura T, Inoue J (September 2004). “Cutting edge: TNFR-associated factor (TRAF) 6 is essential for MyD88-dependent pathway but not toll/IL-1 receptor domain-containing adaptor-inducing IFN-beta (TRIF)-dependent pathway in TLR signaling”. Journal of Immunology. 173 (5): 2913–7. doi:10.4049/jimmunol.173.5.2913. PMID 15322147.21Moors MA, Li L, Mizel SB (July 2001). “Activation of interleukin-1 receptor-associated kinase by gram-negative flagellin”. Infection and Immunity. 69 (7): 4424–9. doi:10.1128/IAI.69.7.4424-4429.2001. PMC 98515. PMID 11401982. Die Aktivierung der IκB-Kinasen trägt zur nukleären Lokalisierung von NF-κB22
Der Nuklearfaktor kappa-light-chain-enhancer of activated B cells (NF-κB) ist ein Proteinkomplex, der die Transkription der DNA, die Zytokinproduktion und das Überleben der Zellen steuert. NF-κB kommt in fast allen tierischen Zelltypen vor und ist an den zellulären Reaktionen auf Stimuli wie Stress, Zytokine, freie Radikale, Schwermetalle, ultraviolette Strahlung, oxidiertes LDL und bakterielle oder virale Antigene beteiligt. NF-κB spielt eine Schlüsselrolle bei der Regulierung der Immunantwort auf Infektionen. Eine fehlerhafte Regulierung von NF-κB wurde mit Krebs, Entzündungs- und Autoimmunerkrankungen, septischem Schock, Virusinfektionen und einer fehlerhaften Immunentwicklung in Verbindung gebracht. NF-κB wird auch mit Prozessen der synaptischen Plastizität und des Gedächtnisses in Verbindung gebracht. (einem proinflammatorischen Zytokin) bei. NF-κB induziert viele nachgeschaltete Genexpressionen, die den kanonischen proinflammatorischen Signalweg einleiten. Diese Interaktion zwischen TLR5 und Flagellum führt zu unterschiedlichen Reaktionen in verschiedenen Zelltypen. In Epithelzellen löst die Bindung der Geißel an TLR5 die Produktion von IL823
Interleukin 8 (IL-8 oder Chemokin (C-X-C-Motiv) Ligand 8, CXCL8) ist ein Chemokin, das von Makrophagen und anderen Zelltypen wie Epithelzellen, glatten Muskelzellen der Atemwege und Endothelzellen produziert wird. Endothelzellen speichern IL-8 in ihren Speicherbläschen, den Weibel-Palade-Körpern. Beim Menschen wird das Interleukin-8-Protein durch das CXCL8-Gen kodiert. IL-8 wird zunächst als Vorläuferpeptid mit 99 Aminosäuren produziert, das dann gespalten wird, um mehrere aktive IL-8-Isoformen zu bilden. In Kultur ist ein Peptid mit 72 Aminosäuren die Hauptform, die von Makrophagen sezerniert wird.
Es gibt viele Rezeptoren auf der Oberflächenmembran, die IL-8 binden können; die am häufigsten untersuchten Typen sind die G-Protein-gekoppelten Serpentinrezeptoren CXCR1 und CXCR2. Expression und Affinität für IL-8 unterscheiden sich zwischen den beiden Rezeptoren (CXCR1 > CXCR2). Über eine Kette von biochemischen Reaktionen wird IL-8 sezerniert und ist ein wichtiger Vermittler der Immunreaktion im Rahmen der angeborenen Immunantwort. aus. Bei menschlichen Monozyten und dendritischen Zellen führt diese Interaktion zur Sekretion von proinflammatorischen Zytokinen wie TNF24
Die Tumor-Nekrose-Faktor (TNF)-Superfamilie ist eine Protein-Superfamilie von Typ-II-Transmembranproteinen, die eine TNF-Homologiedomäne enthalten und Trimere bilden. Mitglieder dieser Superfamilie können durch extrazelluläre proteolytische Spaltung aus der Zellmembran freigesetzt werden und wirken als Zytokin. Diese Proteine werden vor allem von Immunzellen exprimiert und regulieren verschiedene Zellfunktionen, darunter Immunantwort und Entzündung, aber auch Proliferation, Differenzierung, Apoptose und Embryogenese. Die Superfamilie umfasst 19 Mitglieder, die an 29 Mitglieder der TNF-Rezeptor-Superfamilie binden. Das Vorkommen von Orthologen bei Wirbellosen deutet auf einen alten Ursprung dieser Superfamilie in der Evolution hin. Das PROSITE-Muster dieser Superfamilie befindet sich in einem Beta-Sheet im zentralen Abschnitt des Proteins, das bei allen Mitgliedern konserviert ist. 25Miao EA, Andersen-Nissen E, Warren SE, Aderem A (September 2007). “TLR5 and Ipaf: dual sensors of bacterial flagellin in the innate immune system”. Seminars in Immunopathology. 29 (3): 275–88. doi:10.1007/s00281-007-0078-z. PMID 17690885. S2CID 21209470..
In einer neueren Studie wurde Caveolin-126
Caveolin-1 is a protein that in humans is encoded by the CAV1 gene.
als potenzieller Regulator der TLR5-Expression identifiziert.27Lim JS, Nguyen KC, Han JM, Jang IS, Fabian C, Cho KA (December 2015). “Direct Regulation of TLR5 Expression by Caveolin-1”. Molecules and Cells. 38 (12): 1111–7. doi:10.14348/molcells.2015.0213. PMC 4697003. PMID 26615831. Im Gegensatz zur Abnahme der TLR4-Konzentration in alternden Zellen bleibt die TLR5-Expression während des Alterungsprozesses relativ stabil, was mit der hohen Konzentration von Caveolin-1 in alternden Zellen korreliert. Daten von Caveolin-1-Knockout-Mäusen haben gezeigt, dass die TLR5-Expression bei fehlender Caveolin-1-Expression in alternden Zellen signifikant abnimmt. Es wird angenommen, dass Caveolin-1 direkt mit TLR5 interagiert, um es zu stabilisieren, und somit die TLR5-Expression erhöht.
Klinische Relevanz
Quellen und Tiefen
|
Quellen und Tiefen
- 1Rock FL, Hardiman G, Timans JC, Kastelein RA, Bazan JF (January 1998). “A family of human receptors structurally related to Drosophila Toll”. Proceedings of the National Academy of Sciences of the United States of America. 95 (2): 588–93. Bibcode:1998PNAS…95..588R. doi:10.1073/pnas.95.2.588. PMC 18464. PMID 9435236.
- 2
- 3
- 4Kim SJ, Chen Z, Chamberlain ND, Essani AB, Volin MV, Amin MA, Volkov S, Gravallese EM, Arami S, Swedler W, Lane NE, Mehta A, Sweiss N, Shahrara S (October 2014). “Ligation of TLR5 promotes myeloid cell infiltration and differentiation into mature osteoclasts in rheumatoid arthritis and experimental arthritis”. Journal of Immunology. Baltimore, Md. 193 (8): 3902–13. doi:10.4049/jimmunol.1302998. PMC 4185216. PMID 25200955.
- 5Badr MT, Häcker G (2019). “Gene expression profiling meta-analysis reveals novel gene signatures and pathways shared between tuberculosis and rheumatoid arthritis”. PLOS ONE. 14 (3): e0213470. doi:10.1371/journal.pone.0213470. PMC 6405138. PMID 30845171.
- 6Kassem A, Henning P, Kindlund B, Lindholm C, Lerner UH (November 2015). “TLR5, a novel mediator of innate immunity-induced osteoclastogenesis and bone loss”. FASEB Journal. 29 (11): 4449–60. doi:10.1096/fj.15-272559. PMID 26207027.
- 7Castaño-Rodríguez N, Kaakoush NO, Mitchell HM (2014-01-01). “Pattern-recognition receptors and gastric cancer”. Frontiers in Immunology. 5: 336. doi:10.3389/fimmu.2014.00336. PMC 4105827. PMID 25101079.
- 8Husseinzadeh N, Davenport SM (November 2014). “Role of toll-like receptors in cervical, endometrial and ovarian cancers: a review”. Gynecologic Oncology. 135 (2): 359–63. doi:10.1016/j.ygyno.2014.08.013. PMID 25135000.
- 9Sharma N, Akhade AS, Qadri A (April 2013). “Sphingosine-1-phosphate suppresses TLR-induced CXCL8 secretion from human T cells”. Journal of Leukocyte Biology. 93 (4): 521–8. doi:10.1189/jlb.0712328. PMID 23345392.
- 10
- 11Hayashi F, Smith KD, Ozinsky A, Hawn TR, Yi EC, Goodlett DR, et al. (April 2001). “The innate immune response to bacterial flagellin is mediated by Toll-like receptor 5”. Nature. 410 (6832): 1099–103. Bibcode:2001Natur.410.1099H. doi:10.1038/35074106. PMID 11323673. S2CID 4422702.
- 12Smith KD, Andersen-Nissen E, Hayashi F, Strobe K, Bergman MA, Barrett SL, et al. (December 2003). “Toll-like receptor 5 recognizes a conserved site on flagellin required for protofilament formation and bacterial motility”. Nature Immunology. 4 (12): 1247–53. doi:10.1038/ni1011. PMID 14625549. S2CID 6157006.
- 13Andersen-Nissen E, Smith KD, Strobe KL, Barrett SL, Cookson BT, Logan SM, Aderem A (June 2005). “Evasion of Toll-like receptor 5 by flagellated bacteria”. Proceedings of the National Academy of Sciences of the United States of America. 102 (26): 9247–52. Bibcode:2005PNAS..102.9247A. doi:10.1073/pnas.0502040102. PMC 1166605. PMID 15956202.
- 14
- 15Gewirtz AT, Navas TA, Lyons S, Godowski PJ, Madara JL (August 2001). “Cutting edge: bacterial flagellin activates basolaterally expressed TLR5 to induce epithelial proinflammatory gene expression”. Journal of Immunology. 167 (4): 1882–5. doi:10.4049/jimmunol.167.4.1882. PMID 11489966. S2CID 23844864.
- 16Choi YJ, Jung J, Chung HK, Im E, Rhee SH (January 2013). “PTEN regulates TLR5-induced intestinal inflammation by controlling Mal/TIRAP recruitment”. FASEB Journal. 27 (1): 243–54. doi:10.1096/fj.12-217596. PMC 3528317. PMID 23038756.
- 17Rhee SH, Kim H, Moyer MP, Pothoulakis C (July 2006). “Role of MyD88 in phosphatidylinositol 3-kinase activation by flagellin/toll-like receptor 5 engagement in colonic epithelial cells”. The Journal of Biological Chemistry. 281 (27): 18560–8. doi:10.1074/jbc.M513861200. PMID 16644730.
- 18

IRAK-4 gehört zur IRAK-Familie und ist eine Proteinkinase, die an der Signalisierung angeborener Immunreaktionen durch Toll-like-Rezeptoren beteiligt ist. Sie unterstützt auch die Signalübertragung durch T-Zell-Rezeptoren. IRAK4 enthält Domänenstrukturen, die denen von IRAK1, IRAK2, IRAKM und Pelle ähnlich sind. IRAK4 ist im Vergleich zu IRAK1, IRAK2 und IRAKM insofern einzigartig, als es stromaufwärts von den anderen IRAKs funktioniert, aber in dieser Eigenschaft Pelle ähnlicher ist. IRAK4 hat wichtige klinische Anwendungen. Tiere ohne IRAK4 sind anfälliger für Viren und Bakterien, aber völlig resistent gegen LPS. - 19

Die Interleukin-1-Rezeptor-assoziierte Kinase 1 (IRAK-1) ist ein Enzym, das beim Menschen durch das IRAK1-Gen kodiert wird. IRAK-1 spielt eine wichtige Rolle bei der Regulierung der Expression von Entzündungsgenen durch Immunzellen wie Monozyten und Makrophagen, die wiederum das Immunsystem bei der Beseitigung von Bakterien, Viren und anderen Krankheitserregern unterstützen. IRAK-1 gehört zur IRAK-Familie, die aus IRAK-1, IRAK-2, IRAK-3 und IRAK-4 besteht, und wird durch Entzündungsmoleküle aktiviert, die während eines pathogenen Angriffs durch Signalwege freigesetzt werden. IRAK-1 wird als ein Kinase-Enzym eingestuft, das Wege sowohl im angeborenen als auch im adaptiven Immunsystem reguliert. - 20Gohda J, Matsumura T, Inoue J (September 2004). “Cutting edge: TNFR-associated factor (TRAF) 6 is essential for MyD88-dependent pathway but not toll/IL-1 receptor domain-containing adaptor-inducing IFN-beta (TRIF)-dependent pathway in TLR signaling”. Journal of Immunology. 173 (5): 2913–7. doi:10.4049/jimmunol.173.5.2913. PMID 15322147.
- 21Moors MA, Li L, Mizel SB (July 2001). “Activation of interleukin-1 receptor-associated kinase by gram-negative flagellin”. Infection and Immunity. 69 (7): 4424–9. doi:10.1128/IAI.69.7.4424-4429.2001. PMC 98515. PMID 11401982.
- 22

Der Nuklearfaktor kappa-light-chain-enhancer of activated B cells (NF-κB) ist ein Proteinkomplex, der die Transkription der DNA, die Zytokinproduktion und das Überleben der Zellen steuert. NF-κB kommt in fast allen tierischen Zelltypen vor und ist an den zellulären Reaktionen auf Stimuli wie Stress, Zytokine, freie Radikale, Schwermetalle, ultraviolette Strahlung, oxidiertes LDL und bakterielle oder virale Antigene beteiligt. NF-κB spielt eine Schlüsselrolle bei der Regulierung der Immunantwort auf Infektionen. Eine fehlerhafte Regulierung von NF-κB wurde mit Krebs, Entzündungs- und Autoimmunerkrankungen, septischem Schock, Virusinfektionen und einer fehlerhaften Immunentwicklung in Verbindung gebracht. NF-κB wird auch mit Prozessen der synaptischen Plastizität und des Gedächtnisses in Verbindung gebracht. - 23Interleukin 8 (IL-8 oder Chemokin (C-X-C-Motiv) Ligand 8, CXCL8) ist ein Chemokin, das von Makrophagen und anderen Zelltypen wie Epithelzellen, glatten Muskelzellen der Atemwege und Endothelzellen produziert wird. Endothelzellen speichern IL-8 in ihren Speicherbläschen, den Weibel-Palade-Körpern. Beim Menschen wird das Interleukin-8-Protein durch das CXCL8-Gen kodiert. IL-8 wird zunächst als Vorläuferpeptid mit 99 Aminosäuren produziert, das dann gespalten wird, um mehrere aktive IL-8-Isoformen zu bilden. In Kultur ist ein Peptid mit 72 Aminosäuren die Hauptform, die von Makrophagen sezerniert wird.
Es gibt viele Rezeptoren auf der Oberflächenmembran, die IL-8 binden können; die am häufigsten untersuchten Typen sind die G-Protein-gekoppelten Serpentinrezeptoren CXCR1 und CXCR2. Expression und Affinität für IL-8 unterscheiden sich zwischen den beiden Rezeptoren (CXCR1 > CXCR2). Über eine Kette von biochemischen Reaktionen wird IL-8 sezerniert und ist ein wichtiger Vermittler der Immunreaktion im Rahmen der angeborenen Immunantwort. - 24Die Tumor-Nekrose-Faktor (TNF)-Superfamilie ist eine Protein-Superfamilie von Typ-II-Transmembranproteinen, die eine TNF-Homologiedomäne enthalten und Trimere bilden. Mitglieder dieser Superfamilie können durch extrazelluläre proteolytische Spaltung aus der Zellmembran freigesetzt werden und wirken als Zytokin. Diese Proteine werden vor allem von Immunzellen exprimiert und regulieren verschiedene Zellfunktionen, darunter Immunantwort und Entzündung, aber auch Proliferation, Differenzierung, Apoptose und Embryogenese. Die Superfamilie umfasst 19 Mitglieder, die an 29 Mitglieder der TNF-Rezeptor-Superfamilie binden. Das Vorkommen von Orthologen bei Wirbellosen deutet auf einen alten Ursprung dieser Superfamilie in der Evolution hin. Das PROSITE-Muster dieser Superfamilie befindet sich in einem Beta-Sheet im zentralen Abschnitt des Proteins, das bei allen Mitgliedern konserviert ist.
- 25
- 26
- 27Lim JS, Nguyen KC, Han JM, Jang IS, Fabian C, Cho KA (December 2015). “Direct Regulation of TLR5 Expression by Caveolin-1”. Molecules and Cells. 38 (12): 1111–7. doi:10.14348/molcells.2015.0213. PMC 4697003. PMID 26615831.
Hauptquellen der Texte und Materialien:
Internationale Wikipedias. Wurde evtl. ganz oder teilweise ins Deutsche übersetzt. Unter der Creative Commons Attribution-Share-Alike License 4.0 verfügbar; zusätzliche Bedingungen können gelten. Durch die Nutzung dieser Website erklären Sie sich mit den Nutzungsbedingungen und der Datenschutzrichtlinie einverstanden.
Weitere extensive und evtl. aktuellere Ausführungen finden Sie in den zitierten Wikipedia-Artikeln.