Wie das Bindegewebe die Immunbotenstoffe wie ein Schwamm aufsaugt und so eine lebensbedrohliche Ausbreitung im Körper verhindert
GGreift dieser Mechanismus nicht, kann das Immunsystem den eigenen Organismus schädigen, weil sich bestimmte Moleküle systemisch ausbreiten und toxisch wirken.
Die T-Zellen des Immunsystems verständigen sich untereinander. Sie tun dies mit Hilfe von Zytokinen. Ein wichtiger Vertreter dieser Botenstoffe ist das Interferon-gamma. Es aktiviert die körpereigene Abwehr, insbesondere gegen Viren und Bakterien. Um überschießende Immunreaktionen zu vermeiden, hat der Körper im Laufe der Evolution verschiedene Strategien entwickelt. Ein deutsch-französisches Team um Professor Thomas Blankenstein, Leiter der Arbeitsgruppe „Molekulare Immunologie und Gentherapie“ am Max-Delbrück-Centrum in Berlin, hat nun dazu einen besonders wichtigen Wirkmechanismus aufgeklärt.
So kann sich Interferon-gamma über vier Aminosäuren an die extrazelluläre Matrix des Bindegewebes heften, die als Geflecht zwischen den Zellen liegt und deren Kontakt vermittelt. Diese Bindung verhindert, dass sich der Botenstoff ausbreitet und gefährliche Immunreaktionen auslöst. Fehlen die vier Aminosäuren, kommt es zu schweren Störungen der Körperabwehr.
Die molekulare Struktur des Botenstoffs Interferon-gamma ist von Spezies zu Spezies sehr unterschiedlich. Ein kleines Segment aus vier Aminosäuren, das Motiv KRKR, hat sich jedoch in der Evolution der Wirbeltiere seit 450 Millionen Jahren kaum verändert. Daraus entstand die Hypothese, dass das KRKR-Motiv eine wichtige Rolle bei der Zytokinfunktion spielt.
Im Mausmodell zeigte sich, dass hohe Konzentrationen von Interferon-gamma im Blut der Tiere sehr schnell toxisch wirken. Mittels biochemischer Analysen beobachteten die Forschenden, dass der Botenstoff nach der Ausschüttung durch die T-Zellen mit seinen vier positiv geladenen Aminosäuren an die negativ geladene extrazelluläre Matrix bindet – und zwar an das Molekül Heparansulfat.
Auf diese Weise wird Interferon-gamma lokal gebunden und an der Ausbreitung im Körper gehindert. Da sich die Struktur des Heparansulfats jedoch je nach Gewebe, Zelltyp oder sogar Zellzustand unterscheidet, kann auch die Fähigkeit des Bindegewebes, Interferon-gamma zu binden, entsprechend variieren.
Wurde das KRKR-Motiv mit der Genschere CRISPR-Cas9 aus dem Zytokin entfernt, zeigte sich, dass Interferon-gamma auch ohne das KRKR-Motiv wie gewohnt an seinen Rezeptor auf der Zelloberfläche bindet. Immunantworten, bei denen es nur zu sehr kurzen Entzündungsreaktionen kommt, wurden auch so vom Immunsystem der Tiere noch reguliert. Die Menge an Interferon-gamma im Blut stieg zunächst an, fiel aber relativ schnell wieder ab. Lange Zeit ging man davon aus, dass der Botenstoff ohne diese Bindungsstelle gar nicht mehr funktionsfähig ist.
Wurden die Mäuse jedoch mit LCM-Viren infiziert, die eine grippeähnliche Erkrankung, die Lymphozytäre Choriomeningitis, auslösen und das Immunsystem über einen längeren Zeitraum beschäftigen, erkrankten die gentechnisch veränderten Tiere aufgrund der hohen Interferon-Konzentration im Blut sehr schnell.
Die Studie ist von grundlegender Bedeutung für die Immunologie und das Verständnis vieler entzündlicher Erkrankungen des Menschen. Da die extrazelluläre Matrix bei Frauen und Männern unterschiedlich aufgebaut ist, kann der jetzt entdeckte Mechanismus möglicherweise auch erklären, warum manche Infektions- und Autoimmunerkrankungen bei Frauen und Männern so unterschiedlich verlaufen. 1Josephine Kemna et al.( 2023): „IFNγ binding to extracellular matrix prevents fatal systemic toxicity“. Nature Immunology. DOI: 10.1038/s41590-023-01420-52Gemeinsame Pressemitteilung von Max Delbrück Center und Charité – Universitätsmedizin Berlin NR. 5 / 02. FEBRUAR 2023 / BERLIN Wie sich die Körperabwehr selbst in Schach hält
Info-Krümel
Materialien zur Verfügung gestellt durch: Max Delbrück Center und Charité – Universitätsmedizin Berlin
Journal-Referenz:
Josephine Kemna et al.( 2023): „IFNγ binding to extracellular matrix prevents fatal systemic toxicity“. Nature Immunology. DOI: 10.1038/s41590-023-01420-5
Tooltips:
Die Texte in eventuell vorhandenen Tooltip-Fenstern wurden von der Redaktion des W3punkt.de bereitgestellt, sie entstammen in der Hauptsache den englisch- und deutschsprachigen Wikipedias.
DAS TITELBILD
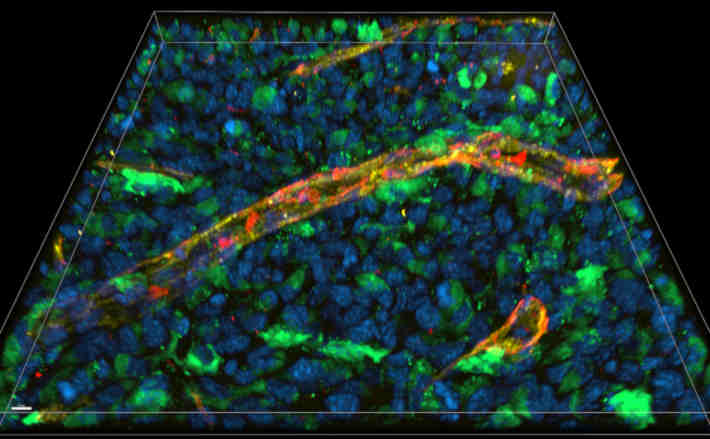
Mikroskopische Analyse eines 16µm dicken Schnitts durch ein Gewebe, in dem der Immunbotenstoff Interferon gamma (IFNγ) freigesetzt wurde: Die Zellkerne des Gewebes sind blau zu sehen, das Interferon grün, Blutgefäße gelb und das Heparansulfat rot. Orange erscheinen Bereiche, in denen Interferon das Heparansulfat bindet. Der Maßstab-Balken markiert 10µm im Schnitt. Foto: AG Blankenstein, Technologieplattform „Advanced Light Microscopy“, Max Delbrück Center
Quellen und Tiefen
- 1Josephine Kemna et al.( 2023): „IFNγ binding to extracellular matrix prevents fatal systemic toxicity“. Nature Immunology. DOI: 10.1038/s41590-023-01420-5
- 2Gemeinsame Pressemitteilung von Max Delbrück Center und Charité – Universitätsmedizin Berlin NR. 5 / 02. FEBRUAR 2023 / BERLIN Wie sich die Körperabwehr selbst in Schach hält