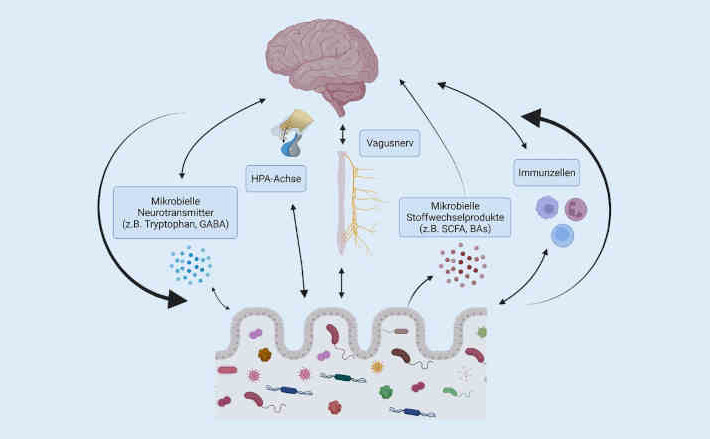
Humane Mikroorganismen, gemeinhin in ihrer Gesamtheit innerhalb eines Wirts als Mikrobiota oder bezogen auf die genetische Information als Mikrobiom bezeichnet, stehen über direkte und indirekte Verbindungen in komplexer Wechselbeziehung zum zentralen Nervensystem.
Zusammenfassung
BBei vielen häufigen psychiatrischen Erkrankungen ist die Zusammensetzung des Mikrobioms verändert. Präklinische Studien haben wichtige Mechanismen aufgedeckt, über die das Mikrobiom in bidirektionaler Wechselwirkung mit neuronalen Funktionen steht. Dysregulationen im komplexen Zusammenspiel von Mikrobiom, Immunsystem, Stressantwort und Energiehomöostase könnten insbesondere in frühen Lebensphasen für die Entwicklung psychiatrischer Symptome im späteren Leben prädisponieren. Obwohl bisher nur wenige klinische Studien vorliegen, haben der weitreichende Einfluss des Mikrobioms auf neuronale und psychische Funktionen sowie seine hohe Plastizität großes Interesse an seinem therapeutischen Potenzial bei häufigen psychiatrischen Störungen geweckt.Hintergrund
Mikroorganismen besiedeln nahezu alle Bereiche unseres Planeten. Ihre Wechselwirkungen untereinander, mit anderen Lebewesen und mit ihrer Umwelt sind von grundlegender Bedeutung für das Funktionieren aller Ökosysteme, für ein stabiles Klima und für das Wohlbefinden von Pflanzen, Tieren und Menschen. Eine ungesunde Lebensweise oder infektiöse Mikroorganismen können dramatische Störungen verursachen, die zu einer Vielzahl von häufigen Krankheiten führen.
Neuere Forschungen haben gezeigt, dass menschliche Mikroorganismen über direkte und indirekte Verbindungen in komplexer Wechselwirkung mit dem zentralen Nervensystem (ZNS) stehen und dadurch die Prädisposition, Entstehung und Aufrechterhaltung psychischer Symptome maßgeblich beeinflussen. Neue Erkenntnisse über diese bidirektionale Beziehung zwischen Mikrobiom und ZNS könnten das Verständnis heterogener, bisher unzureichend verstandener psychiatrischer Krankheitsbilder erweitern und den Weg für neue Biomarker und individualisierte Therapieansätze ebnen.
Infobox
- Etwa 1013 Mikroorganismen besiedeln den menschlichen Körper. Das Verhältnis von Mikroorganismen zu Zellen beträgt etwa 1,3:1.
- Allein im Darm vermutet man ca. 3,3 Millionen mikrobielle Gene gegenüber 22.000 Genen im menschlichen Genom – die mikrobielle DNA ist zudem mit ca. einer Mutation alle 20 Minuten hochvariabel und weist große interindividuelle Unterschiede auf.
- Darüber hinaus ist die Zusammensetzung der Mikrobiota äußerst plastisch. Neben tageszeitlichen Schwankungen können nahezu alle alltäglichen Umwelteinflüsse wie Ernährung, Stress und körperliche Aktivität innerhalb von Stunden zu signifikanten Veränderungen führen.
- Enorme Fortschritte in der Sequenziertechnologie haben gezeigt, dass selbst bisher steril geglaubte Körperkompartimente wie Lunge und Gehirn ein charakteristisches residentes Mikrobiom aufweisen.
- Viele häufige Erkrankungen, einschließlich psychischer Störungen, sind mit charakteristischen Veränderungen des Darmmikrobioms assoziiert.
- Darüber hinaus steht das Mikrobiom in engem Zusammenhang mit verschiedenen physiologischen Eigenschaften, die für psychische Funktionen relevant sind, wie z. B. Neurotransmission, neuronale Plastizität, Stressregulation, Immunsystem und metabolische Faktoren.
Mikrobiota-Hirn-Achse: Kommunikationswege im Zusammenhang mit psychischen Funktionen
Die Redewendungen „Bauchgefühl“, „aus dem Bauch heraus“ und „Wut im Bauch“ existieren nicht nur im übertragenen Sinne. Der weit verbreitete Einsatz von keimfreien (gnotobiotischen) Tiermodellen (GF) sowie von Tieren, deren Mikrobiom durch Antibiotikagabe, pathogene bakterielle Infektionen und fäkale Mikrobiota-Transplantation (FMT) verändert wurde, hat es Mikrobiomforschern in den letzten 20 Jahren ermöglicht, die komplexen Signalwege und Mechanismen aufzudecken, über die menschliche Mikroorganismen in ständiger Wechselwirkung mit dem Gehirn stehen und unter anderem die psychische Gesundheit beeinflussen (Abb. 1).
Mikrobiom und Immunsystem
Die bidirektionale Verbindung mit dem Immunsystem ist einer der zentralen Mechanismen, über die Mikrobiota mit dem ZNS kommunizieren. Einerseits beeinflussen neuronale Schaltkreise die Freisetzung von Zytokinen, um die Homöostase aufrechtzuerhalten und damit überschießende, schädliche Entzündungsreaktionen zu verhindern 1Olofsson PS et al (2012) Rethinking inflammation: neural circuits in the regulation of immunity. Immunol Rev 248(1):188–204, die sich sekundär auch auf die Zusammensetzung des Mikrobioms auswirken können 2Al Bander Z et al (2020) The gut microbiota and inflammation: an overview. Int J Environ Res Public Health 17(20):7618.. Auf der anderen Seite trägt das Mikrobiom über verschiedene, bisher nur unzureichend verstandene Mechanismen entscheidend zur Entwicklung und Reifung des Immunsystems bei 3Zheng D, Liwinski T, Elinav E (2020) Interaction between microbiota and immunity in health and disease. Cell Res 30(6):492–506 PubMedPubMedCentralCrossRef. So konnte in GF gezeigt werden, dass sich bestimmte Komponenten des Immunsystems nicht vollständig entwickeln können, was darauf hindeutet, dass bestimmte wirtsspezifische Bakterien für die vollständige Reifung des Immunsystems unerlässlich sind 4Grasa L et al (2015) Antibiotic-induced depletion of murine microbiota induces mild inflammation and changes in toll-like receptor patterns and intestinal motility. Microb Ecol 70(3):835–848 PubMedCrossRef. Darüber hinaus beeinflussen menschliche Mikroorganismen die relativen Populationen, die Migration und die Funktion verschiedener Immunzellen, einschließlich T-Helferzellen und regulatorischer T-Zellen 5Rooks MG, Garrett WS (2016) Gut microbiota, metabolites and host immunity. Nat Rev Immunol 16(6):341–352 PubMedPubMedCentralCrossRef, die mit einer veränderten Differenzierung bei psychiatrischen Erkrankungen wie der unipolaren Depression in Verbindung gebracht werden 6Grosse L et al (2016) Circulating cytotoxic T cells and natural killer cells as potential predictors for antidepressant response in melancholic depression. Restoration of T regulatory cell populations after antidepressant therapy. Psychopharmacology 233(9):1679–1688 PubMedCrossRef.
Insbesondere die ersten Lebensjahre, in denen Immunzellen lernen, symbiontische Mikroorganismen zu tolerieren, scheinen für die Entwicklung und Ausbildung des Immunsystems entscheidend zu sein 7Jain N (2020) The early life education of the immune system: moms, microbes and (missed) opportunities. Gut Microbes 12(1):1824564 PubMedPubMedCentralCrossRef. Interessanterweise finden grundlegende Ereignisse der Wirtsimmunitätsbildung parallel zu kritischen Zeitpunkten der neuronalen Entwicklung statt 8Gensollen T et al (2016) How colonization by microbiota in early life shapes the immune system. Science 352(6285):539–544 PubMedPubMedCentralCrossRef, in denen auch die Zusammensetzung des Mikrobioms die höchste intra- und interindividuelle Variabilität aufweist, bevor es etwa ab dem dritten Lebensjahr eine stabilere, erwachsenenähnliche Konfiguration erreicht 9Zheng D, Liwinski T, Elinav E (2020) Interaction between microbiota and immunity in health and disease. Cell Res 30(6):492–506 PubMedPubMedCentralCrossRef. Eine Störung der gegenseitigen Wechselwirkungen in dieser frühen Lebensphase, z. B. durch frühkindlichen Stress, könnte mit lang anhaltenden Auswirkungen auf verschiedene Aspekte der Immunhomöostase, einer erhöhten Anfälligkeit für Infektionskrankheiten und einer veränderten Entzündungsreaktion, wie sie bei verschiedenen psychiatrischen Erkrankungen beobachtet wird, verbunden sein 10Werner MCF et al (2022) Immune marker levels in severe mental disorders: associations with polygenic risk scores of related mental phenotypes and psoriasis. Transl Psychiatry 12(1):38 PubMedPubMedCentralCrossRef.
Das Mikrobiom ist direkt an der Reifung und Funktion ZNS-spezifischer Immunzellen beteiligt.
Neben der Etablierung von Komponenten des peripheren Immunsystems ist das Mikrobiom auch direkt an der Reifung und Funktion ZNS-spezifischer immunologischer Zellen beteiligt. So konnte gezeigt werden, dass GF im Vergleich zu konventionell aufgezogenen Tiermodellen eine erhöhte Anzahl unreifer Mikroglia mit veränderter Morphologie aufweisen, die mit einer beeinträchtigten Immunantwort assoziiert sind 11Erny D et al (2015) Host microbiota constantly control maturation and function of microglia in the CNS. Nat Neurosci 18(7):965–977 PubMedPubMedCentralCrossRef. Die postnatale Supplementierung mit kurzkettigen Fettsäuren (SCFA) normalisierte überraschenderweise Form und Funktion der Mikroglia 12Borre YE et al (2014) Microbiota and neurodevelopmental windows: implications for brain disorders. Trends Mol Med 20(9):509–518 PubMedCrossRef.
Darüber hinaus ist auch ein voll ausgebildetes und gut trainiertes erwachsenes Immunsystem weiterhin auf kommensale Mikroorganismen als erste Verteidigungslinie gegen pathogene Keime angewiesen. Ohne eine ausgewogene Zusammensetzung des Mikrobioms als erste Verteidigungslinie wäre der Wirt im ständigen Kampf gegen bakterielle Infektionen hoffnungslos unterlegen, mit weitreichenden lokalen und systemischen Folgen 13Zheng D, Liwinski T, Elinav E (2020) Interaction between microbiota and immunity in health and disease. Cell Res 30(6):492–506 PubMedPubMedCentralCrossRef. Beispielsweise werden chronische milde Entzündungen, die durch erhöhte Konzentrationen zirkulierender proinflammatorischer Zytokine und Akute-Phase-Proteine charakterisiert sind, mit zahlreichen häufigen Erkrankungen einschließlich psychischer Störungen in Verbindung gebracht, wobei die Ursachen noch weitgehend unklar sind 14Beurel E, Toups M, Nemeroff CB (2020) The bidirectional relationship of depression and inflammation: double trouble. Neuron 107(2):234–256 PubMedPubMedCentralCrossRef. Eine mögliche Erklärung ist die sogenannte „leaky gut“-Theorie, nach der bakterielle Antigene durch eine erhöhte Permeabilität des Darmepithels leichter in die Blutbahn gelangen und eine systemische Entzündungsreaktion auslösen 15Nilsson NE et al (2003) Identification of a free fatty acid receptor, FFA2R, expressed on leukocytes and activated by short-chain fatty acids. Biochem Biophys Res Commun 303(4):1047–1052 PubMedCrossRef. Das intestinale Mikrobiom spielt eine fundamentale Rolle bei der Aufrechterhaltung dieser selektiven Permeabilität, da mikrobielle Metaboliten wie SCFA und sekundäre Gallensäuren („bile acids“, BAs) unter anderem die Homöostase des Darmepithels gewährleisten und die Schleimsekretion im Kolon regulieren 16Pearson JP, Brownlee IA (2010) The interaction of large bowel microflora with the colonic mucus barrier. Int J Inflam. https://doi.org/10.4061/2010/321426 CrossRefPubMedPubMedCentral.
Interessanterweise konnte die lange Zeit vorherrschende Vorstellung eines immunprivilegierten autonomen ZNS, das durch die Blut-Hirn-Schranke (BHS) vom peripheren Immunsystem isoliert ist, kürzlich revidiert werden 17Louveau A, Harris TH, Kipnis J (2015) Revisiting the mechanisms of CNS immune privilege. Trends Immunol 36(10):569–577 PubMedPubMedCentralCrossRef. Mit der Entdeckung lymphatischer Gefäße innerhalb der Dura mater18Louveau A et al (2015) Structural and functional features of central nervous system lymphatic vessels. Nature 523(7560):337–341 PubMedPubMedCentralCrossRef und durch periphere Zytokine ausgelöster Signalkaskaden, die zu einem Aufbrechen der tight junctions in den Epithelzellen der BHS mit daraus resultierender erhöhter Permeabilität führen können 19Dantzer R (2018) Neuroimmune interactions: from the brain to the immune system and vice versa. Physiol Rev 98(1):477–504 PubMedCrossRef, beginnt die Forschung erst, den Einfluss peripherer Mechanismen auf neuroinflammatorische Prozesse zu verstehen 20Engelhardt B, Vajkoczy P, Weller RO (2017) The movers and shapers in immune privilege of the CNS. Nat Immunol 18(2):123–131 PubMedCrossRef, die zunehmend als Schlüsselfaktor für die Entstehung psychischer Symptome angesehen werden 21Lurie DI (2018) An integrative approach to neuroinflammation in psychiatric disorders and neuropathic pain. J Exp Neurosci 12:1179069518793639 PubMedPubMedCentralCrossRef. Ähnlich wie auf intestinaler Ebene hat das Mikrobiom auch in hierarchisch übergeordneten Bereichen einen entscheidenden Einfluss auf immuninflammatorische Prozesse. Zum einen konnte gezeigt werden, dass SCFA an der Wiederherstellung von Proteinen des Tight-Junction-Komplexes beteiligt sind und somit für die Aufrechterhaltung der Integrität der BHS unter pathologischen Bedingungen essentiell sind 22Fock E, Parnova R (2023) Mechanisms of blood-brain barrier protection by microbiota-derived short-chain fatty acids. Cells 12(4):657. https://doi.org/10.3390/cells12040657 CrossRefPubMedPubMedCentral. Andererseits exprimieren periphere Lymphozyten vielfach spezifische Rezeptoren für Metaboliten humaner Mikroorganismen 23Nilsson NE et al (2003) Identification of a free fatty acid receptor, FFA2R, expressed on leukocytes and activated by short-chain fatty acids. Biochem Biophys Res Commun 303(4):1047–1052 PubMedCrossRef, die die Rekrutierung aus der systemischen Zirkulation in das ZNS regulieren 24van de Wouw M et al (2019) Monocyte mobilisation, microbiota & mental illness. Brain Behav Immun 81:74–91 PubMedCrossRef, was den Zusammenhang zwischen Mikrobiom, Immunsystem und Mechanismen, die psychiatrischen Symptomen zugrunde liegen könnten, weiter untermauert.
Hohe Komorbidität zwischen parodontalen und psychischen Erkrankungen
Neben dem intestinalen Mikrobiom ist in diesem Zusammenhang auch das orale Mikrobiom von besonderem Interesse. Zum einen besteht eine hohe Komorbidität zwischen parodontalen und psychischen Erkrankungen 25Gurbuz O et al (2010) Oral health and treatment needs of institutionalized chronic psychiatric patients in Istanbul, Turkey. Community Dent Health 27(3):151–157 PubMed. Durch die lokale Entzündungsreaktion gelangen ortsspezifische, symbiotische oder pathogene Mikroorganismen leichter in die Blutbahn 26Kamer AR et al (2008) Inflammation and Alzheimer’s disease: Possible role of periodontal diseases. Alzheimers Dement 4(4):242–250 PubMedCrossRef, wodurch sie sich in anderen „fremden“ Nischen des Körpers ansiedeln und dort schädliche Wirkungen hervorrufen können. Ein eindrucksvolles Beispiel ist die infektiöse Endokarditis, die durch Streptococcus viridans verursacht wird, der als Bestandteil des kommensalen oralen Mikrobioms nach einer hämorrhagischen oralen Behandlung wie einer Zahnextraktion über die Blutbahn in das Herz gelangt 27Birlutiu V, Birlutiu RM, Costache VS (2018) Viridans streptococcal infective endocarditis associated with fixed orthodontic appliance managed surgically by mitral valve plasty: A case report. Medicine 97(27):e11260 PubMedPubMedCentralCrossRef. Zum anderen ist das orale Mikrobiom aufgrund seiner räumlichen Nähe zum Gehirn von besonderem Interesse im Hinblick auf immuninflammatorische Interaktionen mit dem ZNS. So gelangt das Blut aus der Mundhöhle im Gegensatz zu den Gefäßen des Gastrointestinaltraktes nicht zuerst in die Leber, wo mikrobielle Metaboliten über einen „first-pass effect“ bereits metabolisiert werden, sondern direkt in die BHS mit einem möglichen Einfluss auf relevante neuronale Funktionen, die zur Manifestation psychiatrischer Symptome beitragen könnten.
Das Mikrobiom und die Stressverarbeitung
Die Hypothalamus-Hypophysen-Nebennierenrinden-Achse (HPA-Achse) ist vor allem für ihre Rolle bei der Vermittlung der Stressreaktion bekannt. Eine Störung der HPA-Achse ist einer der am häufigsten replizierten pathophysiologischen Befunde bei verschiedenen psychiatrischen Erkrankungen, insbesondere der unipolaren Depression 28Mikulska J et al (2021) HPA axis in the pathomechanism of depression and schizophrenia: new therapeutic strategies based on its participation. Brain Sci. https://doi.org/10.3390/brainsci11101298CrossRefPubMedPubMedCentral. Chronischer Stress ist mit einer reduzierten Diversität des Mikrobioms assoziiert 29Madison A, Kiecolt-Glaser JK (2019) Stress, depression, diet, and the gut microbiota: human-bacteria interactions at the core of psychoneuroimmunology and nutrition. Curr Opin Behav Sci 28:105–110 PubMedPubMedCentralCrossRef. Umgekehrt hat das Darmmikrobiom einen großen Einfluss auf die Entwicklung der HPA-Achse, wie eine bahnbrechende Studie aus dem Jahr 2004 zeigt 30Sudo N et al (2004) Postnatal microbial colonization programs the hypothalamic-pituitary-adrenal system for stress response in mice. J Physiol 558(Pt 1):263–275 PubMedPubMedCentralCrossRef. Sudo und Mitarbeiter fanden, dass GF im Vergleich zur Kontrollgruppe auf milden Stress mit einer erhöhten Ausschüttung von adrenokortikotropem Hormon (ACTH) und Kortikosteron reagieren. Die erhöhte Stress-Reaktion konnte in den GF teilweise durch eine FMT aus der Kontrollgruppe als Donor und vollständig durch die Supplementierung mit einem einzelnen Bakterienstamm (Bifidobacterium infantis) rückgängig gemacht werden 31Sudo N et al (2004) Postnatal microbial colonization programs the hypothalamic-pituitary-adrenal system for stress response in mice. J Physiol 558(Pt 1):263–275 PubMedPubMedCentralCrossRef. Interessanterweise war die Umkehrung der Stress-Reaktion in den GF-Modellen durch FMT oder die Gabe des Probiotikums zeitabhängig, was wiederum auf einen kritischen Zeitpunkt für die Interaktion zwischen Mikrobiom und Wirt bei der Entwicklung elementarer physiologischer Funktionen hindeutet, die die Vulnerabilität für psychische Erkrankungen beeinflussen.
Zentraler Kommunikationsweg zwischen Darmmikrobiom und Gehirn ist der Vagusnerv
Ein möglicher Mechanismus ist neben der mikrobiellen Modulation der zentralen Genexpression relevanter Neurotransmitterrezeptoren die Interaktion mit anderen wichtigen Risikofaktoren, die zu psychiatrischen Symptomen prädisponieren, wie frühkindlicher Stress, Stoffwechselstörungen und eine veränderte Entzündungsreaktion. Dysregulationen in diesen komplexen Wechselwirkungen könnten die Manifestation psychiatrischer Symptome begünstigen oder bei vulnerablen Patientinnen und Patienten sogar verursachen.
Nicht zuletzt trägt Stress zu einer Verschiebung des sympathovagalen Gleichgewichts zu Ungunsten der parasympathischen Modulation bei, was für viele psychiatrische Erkrankungen konsistent beschrieben wurde 32Bär KJ (2015) Cardiac autonomic dysfunction in patients with schizophrenia and their healthy relatives—A small review. Front Neurol 6:139 PubMedPubMedCentralCrossRef. Der N. vagus, dessen Stimulation u. a. antiinflammatorische Effekte vermitteln kann, ist ein zentraler Signalweg der bidirektionalen Kommunikation zwischen Darmmikrobiom und Gehirn. Periphere vagale afferente Fasern reagieren einerseits auf Veränderungen der Mikrobiomzusammensetzung, andererseits direkt auf bakterielle neurometabolische Stoffwechselprodukte und leiten diese in Richtung ZNS weiter 33Forsythe P, Bienenstock J, Kunze WA (2014) Vagal pathways for microbiome-brain-gut axis communication. Adv Exp Med Biol 817:115–133 PubMedCrossRef. Wichtige Erkenntnisse über die Rolle des Nervus vagus bei der Signalübertragung zwischen Mikrobiom und Gehirn konnten durch Vagotomiestudien an Tiermodellen gewonnen werden. So konnten Bravo und Mitarbeitende zeigen, dass die zuvor nachgewiesenen positiven Effekte des Probiotikums Lactobacillus rhamnosus auf das Angstverhalten und die Expression zentraler GABA-Rezeptoren bei vagotomierten Mäusen nicht beobachtet wurden 34Bravo JA et al (2011) Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve. Proc Natl Acad Sci U S A 108(38):16050–16055 PubMedPubMedCentralCrossRef.
Mikrobiom und Energiehomöostase
Viele psychiatrische Erkrankungen gehen mit einem subjektiven Gefühl von Kraft- und Energielosigkeit einher, das sich auch objektiv in einer verminderten körperlichen und kognitiven Leistungsfähigkeit widerspiegelt. Darüber hinaus besteht ein bidirektionaler Zusammenhang zwischen Adipositas und psychischer Gesundheit, der durch Psychopharmakotherapie und ungesunden Lebensstil nur unzureichend erklärt werden kann 35Ding H et al (2022) Shared genetics between classes of obesity and psychiatric disorders: a large-scale genome-wide cross-trait analysis. J Psychosom Res 162:111032 PubMedCrossRef. Umgekehrt konnte gezeigt werden, dass eine FMT bei Patientinnen mit Anorexia nervosa zu einer verminderten Gewichtszunahme bei GF-Mäusen führt 36Fan Y et al (2023) The gut microbiota contributes to the pathogenesis of anorexia nervosa in humans and mice. Nat Microbiol 8(5):787–802 PubMedPubMedCentralCrossRef. Diese Befunde weisen auf eine veränderte Energiehomöostase als einen wichtigen zugrundeliegenden biologischen Faktor hin, der entscheidend zur Entstehung und Aufrechterhaltung psychiatrischer Erkrankungen beitragen kann.
Durch die Verdauung komplexer Makronährstoffe, für die der menschliche Darm nicht die volle enzymatische Kapazität besitzt, sind menschliche Mikroorganismen direkt an der Regulation der Energieaufnahme beteiligt. Daneben beeinflussen Mikrobiota indirekt die Vermittlung von Hunger- und Sättigungssignalen auf verschiedenen Ebenen der Mikrobiom-Hirn-Achse 37Breton J et al (2016) Gut Commensal E. coli proteins activate host satiety pathways following nutrient-induced bacterial growth. Cell Metab 23(2):324–334 PubMedCrossRef.
Zwischen Mikrobiom und Mitochondrien besteht eine bidirektionale Beziehung
Darüber hinaus besteht eine bidirektionale Beziehung zwischen dem Mikrobiom und den Mitochondrien, die beide von primitiven α-Proteobakterien abstammen und mütterlicherseits vererbt werden. Das Mikrobiom ist für die Produktion eines großen Anteils bioaktiver Moleküle verantwortlich, die für wichtige Stoffwechselfunktionen in den Mitochondrien wie Glykolyse, Zitratzyklus oder oxidative Phosphorylierung essentiell sind 38Michaudel C, Sokol H (2020) The gut microbiota at the service of immunometabolism. Cell Metab 32(4):514–523 PubMedCrossRef. Da das Gehirn eines durchschnittlichen Erwachsenen im Ruhezustand 20 % der Körperenergie verbraucht 39Watts ME, Pocock R, Claudianos C (2018) Brain energy and oxygen metabolism: emerging role in normal function and disease. Front Mol Neurosci. https://doi.org/10.3389/fnmol.2018.00216 CrossRefPubMedPubMedCentral, um den hohen Energiebedarf für synaptische Signalübertragung und Neuroproliferation zu decken 40Allen J et al (2018) Mitochondria and mood: mitochondrial dysfunction as a key player in the manifestation of depression. Front Neurosci. https://doi.org/10.3389/fnins.2018.00386 CrossRefPubMedPubMedCentral, ist es sehr anfällig für Bedingungen, die mit einer gestörten Energieproduktion verbunden sind. Dementsprechend wird eine mitochondriale Dysfunktion mit einer verminderten zellulären Resilienz und Neuroplastizität in Verbindung gebracht, was zu einer Prädisposition für psychische Erkrankungen führen könnte 41Bansal Y, Kuhad A (2016) Mitochondrial dysfunction in depression. Curr Neuropharmacol 14(6):610–618 PubMedPubMedCentralCrossRef.
Interessanterweise können auch menschliche Mikroorganismen das Verlangen ihres Wirtes nach bestimmten Nahrungsmitteln, z. B. Kohlenhydraten, beeinflussen, um dem Selektionsdruck zu widerstehen und ihr eigenes Überleben zu sichern. Heißhunger auf Kohlenhydrate wurde immer wieder mit Stimmungsänderungen in Verbindung gebracht, im Sinne einer Art Selbstmedikation zur Aufhellung eines Stimmungstiefs 42Leibenluft E et al (1993) Depressive symptoms and the self-reported use of alcohol, caffeine, and carbohydrates in normal volunteers and four groups of psychiatric outpatients. Am J Psychiatry 150(2):294–301 Wurtman RJ, Wurtman JJ (1995) Brain serotonin, carbohydrate-craving, obesity and depression. Obes Res 3(Suppl 4):477s–480s Corsica JA, Spring BJ (2008) Carbohydrate craving: a double-blind, placebo-controlled test of the self-medication hypothesis. Eat Behav 9(4):447–454 . Darüber hinaus konnte gezeigt werden, dass eine positive Korrelation zwischen einem erhöhten Verlangen nach Kohlenhydraten und der Stimmung besteht 43Christensen L, Pettijohn L (2001) Mood and carbohydrate cravings. Appetite 36(2):137–145 PubMedCrossRef. Umgekehrt wirkt sich eine dysregulierte Kohlenhydratzufuhr negativ auf den Antrieb aus 44Spring B, Chiodo J, Bowen DJ (1987) Carbohydrates, tryptophan, and behavior: a methodological review. Psychol Bull 102:234–256 PubMedCrossRef. Der Rückgriff auf kohlenhydratreiche Nahrungsmittel im Rahmen einer emotionalen Dysbalance verstärkt somit mikrobielle, entzündliche, metabolische und hormonelle Veränderungen, die psychiatrischen Symptomen zugrunde liegen können. Daher könnte das Verlangen nach Kohlenhydraten bei psychischen Erkrankungen sowohl ein Kompensationsmechanismus als auch ein bedingender und aufrechterhaltender Faktor der Störung sein, der ebenfalls durch das Mikrobiom beeinflusst wird.
Das Mikrobiom und die Produktion von Neurotransmittern
Es ist bemerkenswert, dass menschliche Mikroorganismen und ihr Wirt eine gemeinsame neurochemische Sprache verwenden, um mit- und untereinander zu kommunizieren. So ist seit langem bekannt, dass kommensale Mikroben in der Lage sind, direkt Neurotransmitter und Neuromodulatoren zu produzieren, die im gesamten menschlichen Körper eine breite Anwendung finden. Beispielsweise produzieren Lactobacillus spp. und Bifidobacterium spp. Gamma-Aminobuttersäure (GABA), Escherichia spp., Bacillus spp. und Saccharomyces spp. Noradrenalin, Candida spp., Streptococcus spp., Escherichia spp. und Enterococcus spp. Serotonin, Bacillus spp. Dopamin und Lactobacillus spp. Acetylcholin 45Roshchina VV (2016) New trends and perspectives in the evolution of neurotransmitters in microbial, plant, and animal cells. Adv Exp Med Biol 874:25–77 PubMedCrossRef. Folglich stellen diese mikrobiellen neuroaktiven Verbindungen einen potenziellen Mechanismus dar, durch den unser Mikrobiom direkt mit den Nervenzellen des Wirts interagiert. Natürlich sind die von den Bakterien produzierten Mengen relativ gering, und es ist daher fraglich, ob sie einen signifikanten Einfluss auf die Neurotransmission beim Menschen haben. Dennoch könnten auch kleine Mengen Prozesse beeinflussen, die für die psychische Gesundheit relevant sind. So konnte gezeigt werden, dass das Probiotikum Lactobacillus rhamnosus, das in Tiermodellen ängstliches und depressives Verhalten vermindert, auch die Expression des GABA-Rezeptors in verschiedenen Hirnregionen, darunter Kortex, Hippocampus und Amygdala, moduliert 46Bravo JA et al (2011) Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve. Proc Natl Acad Sci U S A 108(38):16050–16055 PubMedPubMedCentralCrossRef und das Sozialverhalten positiv beeinflusst 47Sgritta M et al (2019) Mechanisms underlying microbial-mediated changes in social behavior in mouse models of autism spectrum disorder. Neuron 101(2):246–259.e6 PubMedCrossRef.
Serotonin, das vor allem aufgrund der viel beachteten und inzwischen revidierten Serotonin-Hypothese für affektive Erkrankungen48Schildkraut JJ (1965) The catecholamine hypothesis of affective disorders: a review of supporting evidence. Am J Psychiatry 122(5):509–522 PubMedCrossRef tendenziell als primäres ZNS-Molekül angesehen wird, wird tatsächlich zu mehr als 90 % im Darm synthetisiert. Serotonin selbst kann die BHS nicht passieren, im Gegensatz zu seinem Vorläufermolekül Tryptophan (TRP). TRP wird im Gehirn unter anderem über das Enzym Indolamin-2,3-Dioxygenase (IDO) zum N-Methyl-D-Aspartat (NMDA)-Rezeptorantagonisten Kynurenin metabolisiert. Dysregulationen an dieser Schnittstelle zwischen Serotonin- und Glutamatstoffwechsel können zu weitreichenden Beeinträchtigungen neuronaler Funktionen führen und werden mit verschiedenen neuropsychiatrischen Erkrankungen wie Depression49Woelfer M et al (2019) The role of depressive subtypes within the neuroinflammation hypothesis of major depressive disorder. Neuroscience 403:93–110 PubMedCrossRef und Alzheimer-Demenz50Bonda DJ et al (2010) Indoleamine 2,3-dioxygenase and 3‑hydroxykynurenine modifications are found in the neuropathology of Alzheimer’s disease. Redox Rep 15(4):161–168 PubMedCrossRef in Verbindung gebracht. Interessanterweise wird IDO als eine entscheidende Stellschraube im TRP-Stoffwechsel maßgeblich durch eine Entzündungsreaktion bzw. durch chronischen Stress (HPA-Hyperaktivität) induziert 51Kiank C et al (2010) Psychological stress-induced, IDO1-dependent tryptophan catabolism: implications on immunosuppression in mice and humans. PLoS ONE 5(7):e11825 PubMedPubMedCentralCrossRef, die, wie in den vorangegangenen Kapiteln beschrieben, eng mit Veränderungen des Mikrobioms assoziiert sind. So konnte gezeigt werden, dass die TRP-Konzentrationen im Plasma von GF erhöht und das Verhältnis von Kynurenin zu TRP erniedrigt war 52Wikoff WR et al (2009) Metabolomics analysis reveals large effects of gut microflora on mammalian blood metabolites. Proc Natl Acad Sci U S A 106(10):3698–3703 PubMedPubMedCentralCrossRef, was darauf hindeutet, dass die Mikrobiota die zentrale serotonerge Neurotransmission entscheidend verändert. Der Zusammenhang zwischen diesen Mechanismen und Veränderungen im Mikrobiom, insbesondere in seiner Bedeutung für psychische Erkrankungen, ist jedoch insbesondere beim Menschen noch wenig untersucht (Abb. 2).
Ausblick
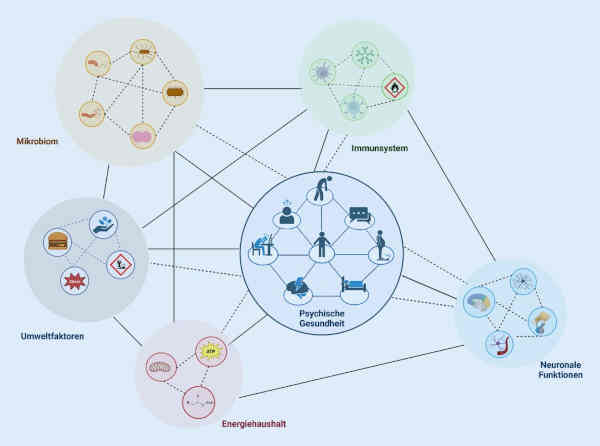
Diese Arbeit konzentriert sich auf erste Erkenntnisse und daraus abgeleitete Hypothesen zu biophysiologischen Prozessen, über die das Mikrobiom die psychische Gesundheit beeinflusst, ohne eine offensichtliche Interaktion mit Verhaltens- oder psychosozialen Faktoren zu berücksichtigen. Gerade diese Interaktion, zentralnervöse Funktionen und ihre Interdependenz auch im Kontext sozialer Interaktion oder andere (z.B. olfaktorische) Wege, über die die Zusammensetzung des Mikrobioms die soziale Interaktion beeinflussen kann, sollten Gegenstand zukünftiger Forschung sein. Vieles deutet auch auf eine mögliche Dysregulation der komplexen Interaktion zwischen menschlichen Mikroorganismen, dem Immunsystem, der Energiehomöostase und der Stressantwort hin, insbesondere zu kritischen Zeitpunkten in der Entwicklung, die für häufige psychiatrische Störungen und komorbide somatische Erkrankungen prädisponieren. Seine enorme Plastizität macht das Mikrobiom besonders interessant als Ziel für alternative therapeutische Interventionen, z.B. durch Lebensstiländerungen oder die Supplementierung mit Prä- und Probiotika, nicht nur im Erwachsenenalter, sondern bereits in der Adoleszenz. Allerdings ist die Evidenzlage für die Wirksamkeit solcher naheliegender Interventionen trotz beeindruckender Einzelstudien53Schaub A‑C et al (2022) Clinical, gut microbial and neural effects of a probiotic add-on therapy in depressed patients: a randomized controlled trial. Transl Psychiatry 12(1):227 PubMedPubMedCentralCrossRef insgesamt noch schwach 54Ansari F et al (2020) The effects of probiotics and prebiotics on mental disorders: a review on depression, anxiety, alzheimer, and autism spectrum disorders. Curr Pharm Biotechnol 21(7):555–565 PubMedCrossRef.
Der absolute Großteil des Wissens über mikrobielle Einflüsse auf psychische Funktionen stammt bislang aus präklinischen Untersuchungen an Tiermodellen. Ansätze translationaler Medizin stecken dagegen noch in den Kinderschuhen mit relativ kleinen Probandenzahlen, fehlender statistischer Aussagekraft und bisher kaum replizierbaren Ergebnissen. Die Forschung in diesem Bereich entwickelt sich jedoch rasant mit einer Zunahme von Studien mit großen Fallzahlen, longitudinalen Designs, effizienteren Sequenzierungstechniken, der Einbeziehung zusätzlicher Biomarker und der Berücksichtigung wichtiger Störvariablen wie z.B. der Ernährung.
Trotz zahlreicher, zum Teil widersprüchlicher Befunde konnte kürzlich in einer systematischen Übersichtsarbeit und Metaanalyse ein übergeordnetes, transdiagnostisches Muster eines veränderten Mikrobioms mit vermindertem Vorkommen bestimmter entzündungshemmender SCFA-produzierender Gattungen und einer Anhäufung proinflammatorischer Bakterien bei unipolarer Depression, bipolarer affektiver Störung, Schizophrenie und Angststörungen identifiziert werden 55Nikolova VL et al (2021) Perturbations in gut microbiota composition in psychiatric disorders: a review and meta-analysis. JAMA Psychiatry 78(12):1343–1354 PubMedCrossRef. Interessanterweise konnte auch ein positiver Zusammenhang zwischen charakteristischen Veränderungen des Mikrobioms und der Symptomschwere bei affektiven Störungen und Schizophrenie gezeigt werden 56Borkent J et al (2022) Role of the gut microbiome in three major psychiatric disorders. Psychol Med 52(7):1222–1242 PubMedPubMedCentralCrossRef. Das stetig wachsende Wissen auf diesem Gebiet hat dazu geführt, dass sich der Fokus der Forschung von der einfachen Identifizierung von Assoziationen zwischen Mikrobiom und Psychopathologie hin zu Untersuchungen der Kausalität und der Übertragung in die klinische Versorgung verschoben hat 57Shoubridge AP et al (2022) The gut microbiome and mental health: advances in research and emerging priorities. Mol Psychiatry 27(4):1908–1919 PubMedCrossRef. Bislang sind die Ergebnisse zu Probiotika und FMT jedoch noch zu begrenzt, um Schlussfolgerungen für den klinischen Alltag ziehen zu können 58Borkent J et al (2022) Role of the gut microbiome in three major psychiatric disorders. Psychol Med 52(7):1222–1242 PubMedPubMedCentralCrossRef.
Mit dem Start des vom Bundesministerium für Bildung und Forschung (BMBF) geförderten Deutschen Zentrums für Psychische Gesundheit (DZP) haben Wissenschaftlerinnen und Wissenschaftler verschiedener Disziplinen seit kurzem ideale Voraussetzungen, entsprechende Forschungsvorhaben in der notwendigen Komplexität und mit großen, längsschnittlich angelegten Untersuchungskohorten durchzuführen. Einen besonderen Fokus auf die Wechselwirkungen zwischen Mikrobiom und psychischer Gesundheit legt beispielsweise der mitteldeutsche DZP-Standort Halle-Jena-Magdeburg (www.C-I-R-C.de) in enger Kooperation mit dem Exzellenzcluster „Balance of the Microverse“ der Universität Jena.
Neue Erkenntnisse über den Einfluss mikrobieller, immunologischer und metabolischer Veränderungen auf zentrale Schaltkreise versprechen daher nicht nur, häufige psychiatrische Störungen biologisch besser zu charakterisieren und individuellere Behandlungsstrategien zu entwickeln, sondern auch z.B. komorbiden Herz-Kreislauf- oder Stoffwechselerkrankungen vorzubeugen.
Schlussfolgerungen für die Praxis
- Psychiatrische Erkrankungen werden mit charakteristischen Veränderungen des Mikrobioms in Verbindung gebracht.
- Das Mikrobiom beeinflusst physiologische Funktionen, die mit der Ätiopathogenese psychiatrischer Symptome in Verbindung gebracht werden.
- Dysregulationen in der Interaktion zwischen Mikrobiom, Immunsystem und neuronaler Entwicklung in der frühen Lebensphase prädisponieren für psychiatrische Erkrankungen.
- Fortschritte in der Sequenziertechnologie ermöglichen effizientere Analysen des Mikrobioms.
- Seine enorme Plastizität macht das Mikrobiom zu einem vielversprechenden Ziel für therapeutische Interventionen bei psychischen Erkrankungen.
Beachtung ethischer Grundsätze
Interessenkonflikt
M. Walter weist auf folgende Beziehungen hin: Zur Ansicht wird JavaScript benötigt! A. Refisch gibt an, dass kein Interessenkonflikt besteht.
Für diesen Beitrag wurden von den Autorinnen und Autoren keine Studien an Menschen oder Tieren durchgeführt. Für die aufgeführten Arbeiten gelten die jeweils angegebenen ethischen Richtlinien.
Open Access Dieser Artikel wird unter der Creative Commons Namensnennung 4.0 International Lizenz veröffentlicht, die die Nutzung, Vervielfältigung, Bearbeitung, Verbreitung und Wiedergabe in jedem Medium und Format erlaubt, solange der/die Urheber und die Quelle genannt, ein Link zur Creative-Commons-Lizenz angegeben und Veränderungen kenntlich gemacht werden. Bilder und andere Materialien Dritter, die in diesem Artikel enthalten sind, unterliegen ebenfalls der oben genannten Creative-Commons-Lizenz, sofern in der Bildunterschrift nichts anderes angegeben ist. Sofern das jeweilige Material nicht unter der genannten Creative-Commons-Lizenz steht und die jeweilige Handlung nicht gesetzlich erlaubt ist, ist für die oben genannte Weiterverwendung des Materials die Zustimmung des jeweiligen Rechteinhabers einzuholen. Weitere Details zur Lizenz entnehmen Sie bitte den Lizenzinformationen unter http://creativecommons.org/licenses/by/4.0/deed.de.
Die Bedeutung des humanen Mikrobioms für die psychische Gesundheit wurde von Dr. med. Alexander Refisch und Martin Walter verfasst und erschien am 17.10.2023 in Ausgabe 11/2023 der Publikation: Der Nervenarzt
Info-Krümel
DIE VERWENDETEN QUELLEN
Materialien zur Verfügung gestellt durch die Autoren.
Journal-Referenz:
Die originalpuplikation erschien 2023 in der Novemberausgabe des „Der Nervenarzt“ unter dem Titel: Die Bedeutung des humanen Mikrobioms für die psychische Gesundheit, verfasst von: Dr. med. Alexander Refisch, Martin Walter.
Das Original wurde unter Zuhilfenahme eines externen Textprozessoren durch die Redaktion des W3Punkt bearbeitet.
Tooltips:
Die Texte in eventuell vorhandenen Tooltip-Fenstern wurden von der Redaktion des W3punkt.de bereitgestellt, sie entstammen in der Hauptsache den englisch- und deutschsprachigen Wikipedias.
Ist dem Originalbeitrag entlehnt.
CC BY 4.0 DEED
Quellen und Tiefen
- 1Olofsson PS et al (2012) Rethinking inflammation: neural circuits in the regulation of immunity. Immunol Rev 248(1):188–204
- 2Al Bander Z et al (2020) The gut microbiota and inflammation: an overview. Int J Environ Res Public Health 17(20):7618.
- 3Zheng D, Liwinski T, Elinav E (2020) Interaction between microbiota and immunity in health and disease. Cell Res 30(6):492–506 PubMedPubMedCentralCrossRef
- 4
- 5Rooks MG, Garrett WS (2016) Gut microbiota, metabolites and host immunity. Nat Rev Immunol 16(6):341–352 PubMedPubMedCentralCrossRef
- 6
- 7Jain N (2020) The early life education of the immune system: moms, microbes and (missed) opportunities. Gut Microbes 12(1):1824564 PubMedPubMedCentralCrossRef
- 8Gensollen T et al (2016) How colonization by microbiota in early life shapes the immune system. Science 352(6285):539–544 PubMedPubMedCentralCrossRef
- 9Zheng D, Liwinski T, Elinav E (2020) Interaction between microbiota and immunity in health and disease. Cell Res 30(6):492–506 PubMedPubMedCentralCrossRef
- 10Werner MCF et al (2022) Immune marker levels in severe mental disorders: associations with polygenic risk scores of related mental phenotypes and psoriasis. Transl Psychiatry 12(1):38 PubMedPubMedCentralCrossRef
- 11Erny D et al (2015) Host microbiota constantly control maturation and function of microglia in the CNS. Nat Neurosci 18(7):965–977 PubMedPubMedCentralCrossRef
- 12
- 13Zheng D, Liwinski T, Elinav E (2020) Interaction between microbiota and immunity in health and disease. Cell Res 30(6):492–506 PubMedPubMedCentralCrossRef
- 14Beurel E, Toups M, Nemeroff CB (2020) The bidirectional relationship of depression and inflammation: double trouble. Neuron 107(2):234–256 PubMedPubMedCentralCrossRef
- 15
- 16Pearson JP, Brownlee IA (2010) The interaction of large bowel microflora with the colonic mucus barrier. Int J Inflam. https://doi.org/10.4061/2010/321426 CrossRefPubMedPubMedCentral
- 17Louveau A, Harris TH, Kipnis J (2015) Revisiting the mechanisms of CNS immune privilege. Trends Immunol 36(10):569–577 PubMedPubMedCentralCrossRef
- 18Louveau A et al (2015) Structural and functional features of central nervous system lymphatic vessels. Nature 523(7560):337–341 PubMedPubMedCentralCrossRef
- 19
- 20
- 21Lurie DI (2018) An integrative approach to neuroinflammation in psychiatric disorders and neuropathic pain. J Exp Neurosci 12:1179069518793639 PubMedPubMedCentralCrossRef
- 22Fock E, Parnova R (2023) Mechanisms of blood-brain barrier protection by microbiota-derived short-chain fatty acids. Cells 12(4):657. https://doi.org/10.3390/cells12040657 CrossRefPubMedPubMedCentral
- 23
- 24
- 25Gurbuz O et al (2010) Oral health and treatment needs of institutionalized chronic psychiatric patients in Istanbul, Turkey. Community Dent Health 27(3):151–157 PubMed
- 26
- 27Birlutiu V, Birlutiu RM, Costache VS (2018) Viridans streptococcal infective endocarditis associated with fixed orthodontic appliance managed surgically by mitral valve plasty: A case report. Medicine 97(27):e11260 PubMedPubMedCentralCrossRef
- 28Mikulska J et al (2021) HPA axis in the pathomechanism of depression and schizophrenia: new therapeutic strategies based on its participation. Brain Sci. https://doi.org/10.3390/brainsci11101298CrossRefPubMedPubMedCentral
- 29Madison A, Kiecolt-Glaser JK (2019) Stress, depression, diet, and the gut microbiota: human-bacteria interactions at the core of psychoneuroimmunology and nutrition. Curr Opin Behav Sci 28:105–110 PubMedPubMedCentralCrossRef
- 30Sudo N et al (2004) Postnatal microbial colonization programs the hypothalamic-pituitary-adrenal system for stress response in mice. J Physiol 558(Pt 1):263–275 PubMedPubMedCentralCrossRef
- 31Sudo N et al (2004) Postnatal microbial colonization programs the hypothalamic-pituitary-adrenal system for stress response in mice. J Physiol 558(Pt 1):263–275 PubMedPubMedCentralCrossRef
- 32Bär KJ (2015) Cardiac autonomic dysfunction in patients with schizophrenia and their healthy relatives—A small review. Front Neurol 6:139 PubMedPubMedCentralCrossRef
- 33
- 34Bravo JA et al (2011) Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve. Proc Natl Acad Sci U S A 108(38):16050–16055 PubMedPubMedCentralCrossRef
- 35
- 36Fan Y et al (2023) The gut microbiota contributes to the pathogenesis of anorexia nervosa in humans and mice. Nat Microbiol 8(5):787–802 PubMedPubMedCentralCrossRef
- 37
- 38
- 39Watts ME, Pocock R, Claudianos C (2018) Brain energy and oxygen metabolism: emerging role in normal function and disease. Front Mol Neurosci. https://doi.org/10.3389/fnmol.2018.00216 CrossRefPubMedPubMedCentral
- 40Allen J et al (2018) Mitochondria and mood: mitochondrial dysfunction as a key player in the manifestation of depression. Front Neurosci. https://doi.org/10.3389/fnins.2018.00386 CrossRefPubMedPubMedCentral
- 41Bansal Y, Kuhad A (2016) Mitochondrial dysfunction in depression. Curr Neuropharmacol 14(6):610–618 PubMedPubMedCentralCrossRef
- 42Leibenluft E et al (1993) Depressive symptoms and the self-reported use of alcohol, caffeine, and carbohydrates in normal volunteers and four groups of psychiatric outpatients. Am J Psychiatry 150(2):294–301 Wurtman RJ, Wurtman JJ (1995) Brain serotonin, carbohydrate-craving, obesity and depression. Obes Res 3(Suppl 4):477s–480s Corsica JA, Spring BJ (2008) Carbohydrate craving: a double-blind, placebo-controlled test of the self-medication hypothesis. Eat Behav 9(4):447–454
- 43
- 44
- 45
- 46Bravo JA et al (2011) Ingestion of Lactobacillus strain regulates emotional behavior and central GABA receptor expression in a mouse via the vagus nerve. Proc Natl Acad Sci U S A 108(38):16050–16055 PubMedPubMedCentralCrossRef
- 47
- 48
- 49
- 50
- 51Kiank C et al (2010) Psychological stress-induced, IDO1-dependent tryptophan catabolism: implications on immunosuppression in mice and humans. PLoS ONE 5(7):e11825 PubMedPubMedCentralCrossRef
- 52Wikoff WR et al (2009) Metabolomics analysis reveals large effects of gut microflora on mammalian blood metabolites. Proc Natl Acad Sci U S A 106(10):3698–3703 PubMedPubMedCentralCrossRef
- 53Schaub A‑C et al (2022) Clinical, gut microbial and neural effects of a probiotic add-on therapy in depressed patients: a randomized controlled trial. Transl Psychiatry 12(1):227 PubMedPubMedCentralCrossRef
- 54
- 55
- 56Borkent J et al (2022) Role of the gut microbiome in three major psychiatric disorders. Psychol Med 52(7):1222–1242 PubMedPubMedCentralCrossRef
- 57
- 58Borkent J et al (2022) Role of the gut microbiome in three major psychiatric disorders. Psychol Med 52(7):1222–1242 PubMedPubMedCentralCrossRef