Über die Wechselwirkungen des Mikrobiom mit Immunsystem, Metabolismus, Pharmaka und Entzündungsprophil der Mikrogliazellen im Alter
Überschriften einblenden ≡
Vorwort
DDas Interesse für Themen aus dem Bereich Ernährung hat sich in letzter Zeit bei mir auf die Forschung um das Darm-Mikrobiom und seine Rolle für die Gesundheit fokussiert. Dies ist eine Patchwork-Arbeit. Extrakte aus mehr als 20 zumeist neueren Veröffentlichungen zum Thema geben wichtige Einblicke.Zusammengefügt in der Hoffnung, in Ihnen das Bewusstsein und Verlangen für eine schöneres Bauchgefühl zu wecken
Dies alles wurde und wird kopiert, geschrieben und geglättet, in der Hoffnung, eine starke Motivation zur Verbesserung des eigenen gastrointestinalen Lebensstils zu sein. Oder anders ausgedrückt, zusammengefügt in der Hoffnung, in Ihnen das Bewusstsein und Verlangen für eine schöneres Bauchgefühl zu wecken.
Über das Darm-Mikrobiom
Das menschliche Mikrobiom ist eines der größten Organe und wiegt bei einem Erwachsenen etwa zwei bis drei Kilogramm (neuere Quelle: 200-300g.1„Es gibt noch große Wissenslücken. „Man liest immer wieder, dass das Mikrobiom eine Masse von 1 bis 2 Kilogramm hat – das stimmt nicht, es sind 200 bis 300 Gramm. Man liest auch immer, die Anzahl der Bakterien im Körper übersteigt die der Körperzellen um das 10-Fache – das stimmt auch nicht, das ist etwa eine 1 zu 1-Relation.“ – Prof. Dr. Thomas Frieling. In „Gesunde Snacks: Mit der Ernährung lässt sich positiv auf das Darmmikrobiom einwirken – aber in wieweit lassen sich daraus Empfehlungen ableiten?“ Ute Eppinger, 25. Juli 2022, https://deutsch.medscape.com/artikelansicht/4911409 ). Darin leben etwa 100 Billionen Mikroorganismen, die aus etwa 500 bis 1.000 verschiedene Arten von Bakterien, Pilzen und anderen Mikroorganismen bestehen.2Hinrichsen F, Hamm J, Westermann M, … Rosenstiel P, Sommer F. Microbial regulation of hexokinase 2 links mitochondrial metabolism and cell death in colitis. Cell Metabolism (2021
https://doi.org/10.1016/j.cmet.2021.11.004 Precision Medicine in Chronic Inflammation3„Nichtsdestotrotz gibt es natürlich Marker für ein Mikrobiom beim Gesunden, z. B. die Reichhaltigkeit der Bakterien. Wenn ein Gesunder durchschnittlich 300-500 Bakterienspezies hat und ein Morbus-Crohn-Patient hat nur noch 30, dann ist das dramatisch weniger.“ – Prof. Dr. Dirk Haller In „Gesunde Snacks: Mit der Ernährung lässt sich positiv auf das Darmmikrobiom einwirken – aber in wieweit lassen sich daraus Empfehlungen ableiten?“ Ute Eppinger, 25. Juli 2022, https://deutsch.medscape.com/artikelansicht/4911409 Die Zusammensetzung des Mikrobioms verändert sich während unseres Lebens und eine
Das menschliche Mikrobiom ist eines der größten Organe und wiegt bei einem Erwachsenen etwa zwei bis drei Kilogramm. Darin leben etwa 100 Billionen Mikroorganismen.
90 Prozent der Zellen an und im menschlichen Körper bestehen aus Bakterien. Diese haben sich auf der Haut und im Darm angesiedelt und sind für den Menschen lebenswichtig. So schützen die Mikroben, die auf der Hautoberfläche leben, vor dem Eindringen von opportunistischen Bakterien und Krankheitserregern.
Um Energie aufzunehmen, braucht der Körper Bakterien. Sie leben im Einklang mit dem Menschen und schützen ihn in der Regel vor Krankheiten. Wenn jedoch das Gleichgewicht dieser Darmflora gestört ist, kann es zu Krankheiten kommen – und diese können den gesamten Körper betreffen.
Lesen Sie mehr dazu: Warum ein Glas Rotwein gut für den Darm ist (engl.). Das Trinken von Rotwein ist mit einer Zunahme der Vielfalt an Darmbakterien verbunden. Rotweintrinker haben ein geringeres Maß an Fettleibigkeit und an „schlechtem“ Cholesterin. Die Schlüsselwirkstoffe dazu sind wahrscheinlich: Polyphenole und Reservatrol.
In den letzten zehn Jahren haben zahlreiche Studien das Profil des Darm-Mikrobioms bei einer Vielzahl von Krankheiten, Lebensstilen, Regionen und auch nach der Geburt untersucht. Die Gemeinschaft des Mikrobioms geht mit bestimmten Bedingungen einher.
Veränderte Konfigurationen des Mikrobioms werden mit vielen Krankheitsbildern assoziiert, das heißt, die Forschung ist meist noch nicht so weit zu sagen, ob diese Veränderungen im Mikrobiom nun die Ursache oder die Folge einer Erkrankung sind.
Entzündliche Darmerkrankungen, Allergien, Autoimmunerkrankungen, Diabetes, metabolisches Syndrom, Fettleber, Arteriosklerose, Schlaganfall, oder auch neurologische und psychiatrische Krankheitsbilder wie Morbus Parkinson, Fatigue-Syndrom, Depression und Autismus zählen dazu.
Es gibt jedoch schon zahlreiche Studien an Tieren, die aufzeigten, dass die Stuhlübertragung eines beispielsweise an Depression Erkrankten, dass Tier ebenso depressiv werden lässt. Solche Übertragungen wurden auch schon für Autismus und andere Krankheitsbilder demonstriert.
Weiterhin gibt es Studien, die demonstrieren konnten, dass ein bestehendes Krankheitsbild sich rapide verschlechtert, wenn das Darm-Mikrobiom mittels Antibiotika ausgeschaltet wurde. So beschleunigte eine Antibiotikabehandlung bei Mäusen, die aufgrund einer Mutation im SOD1-Gen eine amyotrophen Lateralsklerose entwickeln, den Ausbruch der Motoneuronen-Krankheit. Forscher führen diese protektive Wirkung auf ein Darmbakterium zurückführen, das durch die Produktion von Nicotinamid den Krankheitsverlauf verlangsamt.
Bekannt ist auch, dass ein Mangel an bestimmten Bakterien – Clostridien – und ein Überschuss an Desulfovibrio zu Übergewicht führen können.
Das Verständnis der Komplexität des gastrointestinalen Mikrobioms befindet sich noch immer sehr in den Anfängen.
Lesen Sie mehr dazu: „Das menschliche Mikrobiom ist eine Schatzkammer, die darauf wartet, aufgeschlossen zu werden“, von Dr. Vasu Appanna
Der Säugetier-Darm ist warm, feucht und unglaublich nährstoffreich – eine Umgebung, die perfekt für das Bakterienwachstum ist. Die Gemeinschaften der „guten Bakterien” im Darm, die allgemein als Mikrobiome bezeichnet werden, sind lebenswichtige Partner für den Körper. Sie helfen, Ballaststoffe zu verdauen, Nährstoffe zu extrahieren und verschiedene Krankheiten zu verhindern.
Menschliche Kommensalbakterien besiedeln den Verdauungstrakt von Säugetieren seit Hunderttausenden von Jahren. Die natürliche Selektion prägt die bakterielle Evolution in allen Umgebungen. Darm-Mikrobiome sind heterogene und individualisierte Ökosysteme, die im Laufe der Zeit variieren können.
Das menschliche Darm-Mikrobiom birgt ein großes Potenzial für die Entwicklung und Anpassung von Bakterien im Inneren des Menschen. Begegnungen mit anderen Mikroorganismen, dem Immunsystem des Wirtes und der Ernährung können neue selektive Drücke auf Bakterien ausüben, und es ist möglich, dass diese variablen Kräfte das Potenzial für die genomische Anpassung bestimmter kommensaler Arten innerhalb der Person bieten.
Lesen Sie mehr dazu: Hybride Bakterien: Modellstudie untersucht Gentransfer zwischen Bakterien verschiedener Stämme
Kommensale können aber auch eine Person jahrzehntelang stabil kolonisieren trotzdem während dieser Zeit täglich Milliarden von Bakterienmutationen erzeugt werden. Die selektiven Kräfte, die die Anpassung innerhalb der Person antreiben, können personenbezogen, oder weit verbreitet sein.
Beispiele für solche Veränderungen können beinhalten, welche Art von Nahrung eine Person konsumiert, welche Medikamente sie verwendet und welche Lebensstilentscheidungen sie trifft. Auch welchen Umweltexpositionen sie ausgesetzt ist und welche physiologischen Veränderungen im Wirt. Dazu gehören auch die Up- und Down-Regulation in verschiedenen Wirtsgenen oder ob eine Person eine Krankheit entwickelt.
Lesen Sie mehr dazu: Der Umzug in ein anderes Land könnte Ihre Darmbakterien schädigen (engl.). Eine überzeugende neue Studie, die in Cell veröffentlicht wurde, deutet darauf hin, dass die Migration zwischen bestimmten Ländern die Bakterien, die in unserem Verdauungssystem leben, zutiefst beeinflussen kann, mit wichtigen Auswirkungen auf unsere Gesundheit.
Die Autoren der Studie betrachteten die Ernährung, die Darmmikroben und den Body-Mass-Index von asiatischen Einwanderer vor und nach ihrem Umzug. Die Daten zeigten, dass je länger die Einwanderer in den USA blieben, desto weniger vielfältig wurden ihre Bakterien, und dass dies mit zunehmender Fettleibigkeit verbunden war.
Veränderungen am Darm-Mikrobiom begannen, sobald die Einwanderer in die USA kamen und es veränderte sich über Jahrzehnte hinweg weiter. Je länger sie dort lebten, desto mehr ähnelten ihre Mikrobiome denen von gebürtigen Amerikanern europäischer Herkunft.
Westliche Eingeweide enthalten häufig viele Bacteroides-Arten, die gut darin sind, tierische
Der Darm von Menschen mit pflanzenreicher Ernährung wird in der Regel von Prevotella-Arten dominiert, die gut in der Verdauung von Pflanzenfasern sind
Die neue Studie ergab, dass Bakterienstämme aus den Heimatländern der Einwanderer, insbesondere Prevotella-Arten, vollständig verloren gingen, ebenso wie relevante Enzyme für die Verdauung wichtiger Pflanzenfasern.
Durch Vergleiche mit öffentlichen Metagenomen zeigte sich, dass manche adaptive Mutation kulturspezifisch auftritt, zum Beispiel, dass sie häufig in westlichen, aber nicht in chinesischen Mikrobiomen zu finden ist.
Ihre Identifizierung könnte mikrobiomenspezifische Therapien leiten – einschließlich der Auswahl oder Entwicklung therapeutischer Bakterien für die langfristige Kolonisierung.
Darüber hinaus kann die Anpassung innerhalb der Person, falls sie stattfindet, zur Stabilität der Mikrobiomgemeinschaften und ihrer Widerstandsfähigkeit gegen Invasionen beitragen.
Intraindividuelle Bacteroides-fragilis-Populationen können dabei jahrelange ihre innerpersönliche Geschichte bewahren. Und es gibt Beweise für eine jahrelange Koexistenz
Intraindividuelle Bacteroides-fragilis-Populationen können jahrelange ihre innerpersönliche Geschichte bewahren
Die meisten Forschungsarbeiten konzentrieren sich bisher auf die Kartierung der Arten von Bakterien, die in unserem Körper leben, um festzustellen, ob und wie das Vorhandensein einer bestimmten Bakterienart das Krankheitsrisiko beeinflussen könnte. Im Gegensatz dazu geht die neuere Forschung viel tiefer und betrachtet die Gene, aus denen die verschiedenen mikrobiellen Arten und Stämme bestehen.
Die neuere Forschung betrachtet die Gene, aus denen die verschiedenen mikrobiellen Arten und Stämme bestehen
Die Untersuchung von Bakterienarten allein wird nur teilweise Hinweise auf die Rolle dieser Mikroorganismen bei Krankheit und Gesundheit liefern. Da der genetische Gehalt zwischen denselben Mikroben stark variiert, ist es ebenso wichtig zu verstehen, wie und ob einzelne mikrobielle Gene das Krankheitsrisiko beeinflussen.
Zwei Mitglieder desselben Bakterienstamms könnten eine deutlich unterschiedliche
Der genetische Gehalt zwischen denselben Mikroben variiert stark
Der genetische Gehalt zwischen denselben Mikroben variiert stark. So sind 50% aller Gene in einer metagenomischen Probe individuell spezifisch, diese werden als Singletons bezeichnet.
Die Profilierung dieser einzigartigen Gene, aus denen sich das Mikrobiom einer Person
50% aller Gene in einer metagenomischen Probe ist individuell spezifisch und werden als Singletons bezeichnet
Die Analyse zeigt, dass gemeinsame Gene an mehr oder weniger grundlegenden Funktionen beteiligt zu sein scheinen, die für das tägliche Überleben einer Mikrobe entscheidend sind. Dazu gehören vor allem der Verbrauch und der Abbau von Enzymen, die Energieumwandlung und der Stoffwechsel.
Einzigartige Gene hingegen haben eher spezialisierte Funktionen, wie z.B. die Resistenz gegen Antibiotika und andere Belastungen und den Aufbau der schützenden Zellwand einer Mikrobe, die sie vor äußeren Einflüssen schützt.
Wenn eine Mikrobe durch die Einwirkung von Medikamenten gegen ein Antibiotikum
Einzigartige Gene haben eher spezialisierte Funktionen, wie z.B. die Resistenz gegen Antibiotika und andere Belastungen
Mikroben pflegen den freien Austausch von DNA-Material mit ihren Nachbarn – ein Phänomen, das als horizontaler Gentransfer bekannt ist. Untersuchungen zeigten jedoch, dass nur knapp 2 Prozent der im Darm gefundenen Gene durch diesen benachbarten Genaustausch entstanden sind.
Knapp 2 % der im Darm gefundenen Gene beruht auf dem horizontalem Genaustausch
Forscher gehen daher davon aus, dass ein weiterer, stärkerer Treiber der genetischen Vielfalt die Fähigkeit von Bakterien sein könnte, ihre DNA als Reaktion auf Veränderungen in der Wirtsumgebung schnell zu entwickeln.
Das Haut-Mikrobiom von kohabitierenden Paaren
Ausgeprägte mikrobielle Gemeinschaften bewohnen Individuen als Teil des menschlichen Haut-Mikrobioms und werden kontinuierlich an die Umgebung abgegeben. Mikrobielle Gemeinschaften aus 17 Hautstellen von 10 sexuell aktiven Paaren (20 Individuen) wurden untersucht, um zu testen, ob das Zusammenleben das Haut-Mikrobiom einer Person beeinflusst, was zu einer gemeinsamen Haut-Mikrobiota unter den Partnerpaaren führt.
Verstärkte 16S rRNA-Gene von Bakterien und Archäen aus insgesamt 340 Hautabstrichen wurden durch Hochdurchsatz-Sequenzierung analysiert. Die Ergebnisse zeigten, dass das Zusammenleben signifikant mit der mikrobiellen Gemeinschaftszusammensetzung verbunden war. Jedoch wurden diese Assoziationen durch Merkmale der Körperstellen und der Individualität weit übertroffen.
Die zufällige Forest-Modellierung zeigte, dass die Partner in 86 % der Fälle basierend auf
Untersuchungen zeigten, dass ein Zusammenleben signifikant mit der Zusammensetzung der mikrobiellen Gemeinschaft korreliert
Kohabitierende Paare hatten die ähnlichsten mikrobiellen Hautgemeinschaften an den Füßen, je nach Entfernung von Bray-Curtis.
Im Gegensatz dazu waren die mikrobiellen Gemeinschaften der Oberschenkel stark mit biologischem Geschlecht und nicht mit dem Lebenspartner verbunden.
Kohabitierende Paare hatten die ähnlichsten mikrobiellen Hautgemeinschaften an den Füßen
Weitere Faktoren, die mit dem Haut-Mikrobiom bestimmter Körperregionen in Verbindung gebracht wurden, waren die Verwendung von Hautpflegeprodukten, Tierbesitz, Allergien und Alkoholkonsum.
Diese Basisdaten identifizierten Zusammenhänge zwischen dem Haut-Mikrobiom und den täglichen Interaktionen zwischen zusammenlebenden Individuen und fügten bekannte Faktoren hinzu, die das menschliche Mikrobiom und damit seine Beziehung zur menschlichen Gesundheit prägen. 4 The Skin Microbiome of Cohabiting Couples Ashley A et al. July 2017 American Society for Microbiology Journals https://doi.org/10.1128/mSystems.00043-17 Creative Commons Attribution 4.0 International license Abgesehen von der Übersetzung wurden keine größeren Veränderungen vorgenommen
Zusammenlebende Familienmitglieder teilen sich Mikrobiota untereinander und mit ihren Hunden
Menschlich assoziierte mikrobielle Gemeinschaften variieren von Mensch zu Mensch: Mögliche Faktoren sind (genetische) Verwandtschaft, Ernährung und Alter. Aber auch unsere Umgebung, einschließlich der Menschen, mit denen wir interagieren, prägen wahrscheinlich unsere mikrobiellen Gemeinschaften.
Um diesen mikrobiellen Austausch zu quantifizieren, wurden in dieser Studie Stuhl-, Mund- und Haut-Mikrobiota aus 60 Familien (eheliche Einheiten mit Kindern, Hunden, beides oder keinem) untersucht.
Haushaltsmitglieder, insbesondere Paare, teilten mehr von ihrer Mikrobiota als Einzelpersonen aus verschiedenen Haushalten, mit stärkeren Auswirkungen des Zusammenlebens auf die Haut als orale oder fäkale Mikrobiota.
Die Hundehaltung erhöhte die gemeinsame Haut-Mikrobiota bei zusammenlebenden Erwachsenen signifikant, und die hundebesitzenden Erwachsenen teilten mehr „hautnahe“ Mikrobiota mit ihren eigenen Hunden als mit anderen Hunden.
Obwohl der Grad, in dem diese gemeinsamen Mikroben eine echte Nische im menschlichen Körper haben, im Vergleich zum vorübergehenden Nachweis nach direktem Kontakt unbekannt ist, deuten diese Ergebnisse darauf hin, dass der direkte und häufige Kontakt mit unseren Lebensgefährten die Zusammensetzung unserer mikrobiellen Gemeinschaften maßgeblich beeinflussen kann. 5Cohabiting family members share microbiota with one another and with their dogs Se Jin Song et al. April 2013 doi: 10.7554/eLife.00458 US National Library of Medicine
National Institutes of Health,
Creative Commons Attribution 3.0 Unported (CC BY 3.0)
Enge soziale Beziehungen korrelieren mit der Zusammensetzung der menschlichen Darm-Mikrobiota
Soziale Beziehungen prägen die menschliche Gesundheit und Sterblichkeit durch verhaltensbedingte, psychosoziale und physiologische Mechanismen, einschließlich Entzündungs- und Immunreaktionen.
Obwohl nicht in Humanstudien getestet, deuten aktuelle Primaten-Studien darauf hin, dass das Darm-Mikrobiom auch ein biologischer Mechanismus sein kann, der die (sozialen) Beziehungen mit der Gesundheit verbindet.
Bei der Integration von Mikrobiotendaten in die 60-jährige Wisconsin Longitudinal Study wurde festgestellt, dass die Sozialität mit Familie und Freunden mit Unterschieden in der menschlichen Kot-Mikrobiota verbunden ist.
Die Analyse von Ehepartnern (N = 94) und Geschwisterpaaren (N = 83) ergab ferner, dass Ehepartner ähnlichere Mikrobiota und mehr bakterielle Taxa gemeinsam haben als Geschwister, ohne dass Unterschiede zwischen Geschwistern und unabhängigen Paaren beobachtet wurden.
Diese Unterschiede hielten auch nach Berücksichtigung von Ernährungsfaktoren an. Die Unterschiede zwischen unabhängigen Personen und verheirateten Paaren wurden ausschließlich von Paaren verursacht, die über enge Beziehungen berichteten; es gab keine Unterschiede in der Ähnlichkeit zwischen Paaren, die über etwas enge Beziehungen berichteten, und unabhängigen Personen.
Darüber hinaus beherbergen verheiratete Personen mikrobielle Gemeinschaften von
Bei verheirateten Personen ist die mikrobielle Gemeinschaften von größerer Vielfalt und Reichtum im Vergleich zu Alleinstehenden
Diese Ergebnisse deuten darauf hin, dass menschliche Interaktionen, insbesondere anhaltende, enge eheliche Beziehungen, die Darm-Mikrobiota beeinflussen. 6Close social relationships correlate with human gut microbiota composition Kimberly A. Dill-McFarland et al. Januar 2019 Scientific Reports DOI https://doi.org/10.1038/s41598-018-37298-9 Open Access Creative Commons Attribution 4.0 International Außer geringfügigen übersetzungsbedingten Modifikationen, kein Änderungen
Die Blutgruppe als ein Faktor der Komposition des humanen Darmmikrobioms
In der Forschung nach dem Einfluss, den die Mikroorganismen, die in und auf dem
Bei einigen Menschen werden die Blutgruppenantigene nicht nur auf den Oberflächen der roten Blutkörperchen gebildet, sondern auch in den Darm sekretiert. Diese bestehen vor allem aus Zuckerresten, die von einigen Bakterien der Bacteroides-Gruppe vermutlich als Energiequelle genutzt werden können
So gilt nun eine bislang unbekannte Kausalkette zwischen den die Blutgruppe bestimmenden Genvariationen und dem Vorkommen und der Häufigkeit bestimmter Bakterienarten im Mikrobiom als belegt. Bei einigen Menschen werden die Blutgruppenantigene nicht nur auf den Oberflächen der roten Blutkörperchen gebildet, sondern auch in den Darm sekretiert. Diese bestehen vor allem aus Zuckerresten, die von einigen Bakterien der Bacteroides-Gruppe vermutlich als Energiequelle genutzt werden können, sodass diese vermehrt vorkommen.
Insbesondere bei Menschen mit den Blutgruppen A, AB oder B scheint dies das Vorkommen dieser Bakterien im menschlichen Darm zu begünstigen. Bei etwa 20 Prozent der weltweiten Bevölkerung, die zur Gruppe der ‚Nicht-Sekretoren‘ gehören, sowie bei Personen mit der Blutgruppe 0, fällt die Abgabe der Zuckerreste weg und ihre Mikrobiom-Zusammensetzung weicht in der Folge ab.
Diese Stoffwechselprodukte scheinen wichtige Moleküle in der Interaktion von Wirt und
Neben Umwelt- und Ernährungseinflüssen ist auch die Genetik des menschlichen Körpers ein zentraler Faktor, der die bakterielle Besiedlung beeinflusst und somit das Mikrobiom mehr als eine zufällige Zusammenstellung von in der Umwelt verfügbaren Mikroorganismen
Im größeren Maßstab liefern solche Ergebnisse weitere Erklärungsansätze für das Zustandekommen des anthropomorphen Mikrobioms insgesamt: Neben Umwelt- und Ernährungseinflüssen ist auch die Genetik des menschlichen Körpers ein zentraler Faktor, der die bakterielle Besiedlung beeinflusst und somit das Mikrobiom mehr als eine zufällige Zusammenstellung von in der Umwelt verfügbaren Mikroorganismen.
So werden in der Forschung laufend weitere Faktoren identifizieren, die die Zusammensetzung und Balance des Darmmikrobioms mitbestimmen. Dies auch mit dem Ziel, kritische Bakterienarten zu erkennen, deren Vorkommen und Häufigkeit sowohl als Risiko- wie auch als Schutzfaktoren der mikrobiellen Besiedlung des Körpers gelten, um künftig Krankheiten, die auf einer gestörten Bakterienbesiedlung beruhen, gezielt behandeln zu können. 7Blutgruppe bestimmt Zusammensetzung des Darmmikrobioms mit, CAU Christian-Albrechts-Universität zu Kiel, 18.01.2021,8Genome-wide association study in 8,956 German individuals identifies influence of ABO histo-blood groups on gut microbiome, Nature Genetics, 18 Januar 2021
Das Universum der mikrobiellen Gene
Die Landschaft der genetischen Inhalte im menschlichen Mikrobiom. Untersuchungen zur Heterogenität der mikrobiellen Genetik, mit besonderem Schwerpunkt darauf, wie Mikroben und ihre Gene ihre Umwelt und damit die menschliche Gesundheit beeinflussen. Eine Datenbank mit dem Ziel, das aktuelle Verständnis von Variation und Funktion in der mikrobiellen Sequenz-Diversität weltweit zu erweitern.
Eine Cross-Study-Meta-Analyse von Metagenomen aus zwei Nischen, dem Mund und Darm. 3.655 Proben aus 13 Studien. In diesem Datensatz wurde eine atemberaubende genetische Heterogenität gefunden. Mit ihm wurden auf der 95 % Identitätsebene insgesamt 45.666.334 nicht-redundante Gene identifizierte (23.961.508 im Mund, 22.254.436 im Darm).
50% der Gene in beiden Datensätzen sind „Singletons“, was bedeutet, dass sie für eine einzige metagenomische Probe einzigartig waren. Singletons wurden für diskrete Funktionen angereichert und entstanden aus subpopulations-spezifischen und extrem seltenen mikrobiellen Stämmen. Insgesamt dienen diese Ergebnisse als mögliche Erklärung für die große, unerklärliche Heterogenität, die bei mikrobiologisch gewonnenen menschlichen Phänotypen beobachtet wird. Harvard Medical School, Department of Bioinformatics und das Joslin Diabetic Center: The Universe of Microbial Genes
Darm-Mikrobiom, Immunsystem, Stoffwechsel
Die Gemeinschaft der Mikroorganismen im Darm übt einen regulatorischen Einfluss auf
Die Gemeinschaft der Mikroorganismen im Darm übt einen regulatorischen Einfluss auf unser Immunsystem aus. Der größte Teil des menschlichen Immunsystems findet sich im Darm.
Das Immunsystem reagiert energisch auf mikrobielle Infektionen und ermöglicht gleichzeitig eine lebenslange Besiedlung durch das Mikrobiom.
Der Darm produziert Immunglobulin A (IgA)-Antikörper in Gramm-Mengen, von denen angenommen wird, dass sie den Darm vor Krankheitserregern schützen.
So werden aber auch im Darmtrakt IgA-Imunzellen zur Antikörperproduktion trainiert, die sich später in der Dura mater, der äußersten Lage der Meningen, wiederfinden, um in diesem besonders gefärdeten Bereich der großen venösen Strukturen und ihren Sinuiden den immunologischen Schutz vor infektiösen Erregern zu gewährleisten. Diese Antikörper-produzierenden IgA-Zellen finden sich auch in Schleimhautschichten des Bronchialbaumes
Der Darm produziert Immunglobulin A (IgA)-Antikörper in Gramm-Mengen.
Hier werden IgA-Imunzellen zur Antikörperproduktion trainiert, die sich später in der Dura mater, der äußersten Lage der Meningen, wiederfinden
Die Forscher glauben, dass IgA-Antworten zusätzlich zu ihrer Rolle bei der Beseitigung von Krankheitserregern vom Mikrobiom kooptiert werden können, um eine robuste hostmikrobielle Symbiose zu schaffen.
In Tierexperimenten wurde gezeigt, dass insbesondere der Verlust von Clostridien und die Zunahme von Desulfovibrio-Bakterien dazu führt, dass die Tiere Gewicht zulegten. Diese Bakterien scheinen die Aufnahme von Nahrungsfetten über das Darmepithel zu regulieren.
Der Ablauf könnte direkt durch das Immunsystem gesteuert sein. Es sorgt dafür, dass IgA in den Darm entlassen wird und dort schädliche Bakterien wie Desulfovibrio erkennt und eindämmt. Dadurch können sich die nützlichen Bakterien, wie zum Beispiel Vertreter aus der Familie der Clostridien, vermehren. Einige Clostridien sorgen dafür, dass die Darmzellen nicht übermäßig viele Fette aufnehmen und kontrollieren damit den gesunden Stoffwechsel des Menschen.
Neu ist, dass ein Defekt im Immunsystem, der zu einer Verminderung an Immunglobulin A im
Darmbakterien von Mäusen mit kalorienreduzierter Diät produzieren weniger toxische Lipopolysaccharide (LPS)
Darmbakterien von Mäusen mit kalorienreduzierter Diät produzieren weniger toxische Lipopolysaccharide (LPS). Die bakteriellen LPS-Moleküle lösen eine Immunreaktion aus, indem sie den spezifischen Signalrezeptor TLR4 (Toll-like Receptor 4) aktivieren.
So verlängert eine kalorienarme Ernährung das Leben von Mäusen und sie werden auch gesünder und schlanker. Ausschlaggebend ist die Darmflora und ihre Auswirkung auf das Immunsystem.
Das Immunsystem wird nicht nur vom Mikrobiom kooptiert um eine robuste hostmikrobielle Symbiose zu schaffen oder Infektionen zu bekämpfen, sondern es spielt auch eine Schlüsselrolle bei der Stoffwechselregulierung.
Das Immunsystem hält die Darmflora im Gleichgewicht
Im Darm leben Billionen von Bakterien. Sie werden vom Immunsystem in einem permanenten Gleichgewicht gehalten und sind deshalb unschädlich für den Menschen. Forschende konnten im Mausmodel zeigen, wie Antikörper im Darm diese Bakterien in Schach halten.
IgA-Antikörper schränken die Fitness der gutartigen Bakterien auf mehreren Ebenen gezielt ein. Dies ermöglicht dem Immunsystem die Feinregulierung des mikrobiellen Gleichgewichts im Darm. Das Immunsystem erkennt spezifische Bakterien und schränkt sie sowohl im Wachstum als auch in ihrer Aktivität ein.
Spezifische Antikörper kontrollieren die Fitness der Bakterien durch die Einschränkung ihrer Beweglichkeit oder durch die Behinderung die Aufnahme von Zuckerbausteinen für deren Stoffwechsel. Der Effekt ist davon abhängig, welcher Oberflächenbaustein erkannt wird.
So hat das Immunsystem offenbar die Möglichkeit, auch die gutartigen Darmbakterien über verschiedene Wege gleichzeitig zu beeinflussen. Die Frage, wieso das Immunsystem mit den gutartigen Bakterien im Darm ein Gleichgewicht erzielt, pathogene Eindringlinge dagegen wirksam vernichten kann, ist nach wie vor nicht abschließend geklärt.10Immunsystem hält Darmflora im Gleichgewicht https://www.unibe.ch/aktuell/medien/media_relations/medienmitteilungen/2021/medienmitteilungen_2021/immunsystem_haelt_darmflora_im_gleichgewicht/index_ger.html11Tim Rollenske, Sophie Burkhalter, Lukas Muerner, Stephan von Gunten, Jolanta Lukasiewicz, Hedda Wardemann and Andrew J. Macpherson: Parallelism of intestinal secretory IgA shapes functional microbial fitness, Nature, 13 October 2021. doi: 10.1038/s41586-021-03973-7 https://www.nature.com/articles/s41586-021-03973-7
Lesen Sie mehr dazu: Der Einfluss von Lebensmittelantigenen auf die Homöostase des Darms
Unsere Nahrung löst im Dünndarm eine Immunantwort aus, die dadurch in Schach gehalten wird, dass die beteiligten Immunzellen absterben. Bei der Verfolgung des Schicksals von T-Zellen in den Peyer-Plaques, das sind lymphknotenartige Strukturen im Dünndarm, die Ansammlungen von Immunzellen enthalten, fand man, dass sie diejenigen Orte im Verdauungstrakt sind, an denen Immunantworten initiiert werden.
T-Zellen wandern aus Darm und Haut ins Zentrale Nervensystem
Schon länger ist bekannt, dass eine Verbindung zwischen dem Darm-Mikrobiom und dem Zentralen Nervensystem (ZNS) besteht. Die Verbindung zwischen dem Darm-Mikrobiom und dem ZNS, die sogenannte „Darm-Hirn-Achse“, wird für vieles mitverantwortlich gemacht: für das Gewicht eines Menschen, für Autoimmunerkrankungen, Depressionen, psychische Erkrankungen oder Alzheimer. Bisher war es allerdings nicht gelungen, die Immunzellen zu zeigen, die vom Darm ins ZNS und damit ins Hirn wandern.
Das Immunsystem wird von Umweltfaktoren beeinflusst. T-Zellen sammeln Informationen und transportieren diese auch in das ZNS, also ins Gehirn und Rückenmark, wo dann eine Immunreaktion ausgelöst werden kann. Wie und von welchem Ausgangspunkt die T-Zellen tatsächlich ins ZNS gelangen, war allerdings lange unklar.
Ein Forschungsteam konnte nun die Wanderung der T-Zellen mit violettem Licht sichtbar machen.
T-Zellen aus der Haut wanderten in die graue und weiße Substanz des ZNS, T-Zellen aus dem Darm fast ausschließlich in die weiße Substanz.
Damit wurde gezeigt, dass Umwelteinflüsse die T-Zellen in den Darm- oder Hautlymphknoten prägen und dann diese Informationen mit in die fernen Organe transportieren.
Wüsste man zum Beispiel, ob Darm- oder Hautzellen die Erkrankung einer Multiplen Sklerose ausgelöst haben, könnten die T-Zellen am Ausgangspunkt der Erkrankung behandelt und Vorhersagen für das Fortschreiten der chronischen Entzündung und der Autoimmunität getroffen werden. Auch für andere Autoimmunerkrankungen oder Krebs könnten die Erkenntnisse einen Durchbruch für die Therapie bedeuten. 12Skin and gut imprinted helper T cell subsets exhibit distinct functional phenotypes in central nervous system autoimmunity. Nat Immunol 22, 880–892 (2021).
https://doi.org/10.1038/s41590-021-00948-813Botengänger zwischen Darm und Gehirn, Technische Universität München, 06.09.2021
Es gibt eine Gruppe von Darmmikroben und darin eine spezifische Spezies, die Immunzellen dazu veranlasst, virusabweisende Chemikalien, so genannte Typ-1-Interferone, freizusetzen.
Schwache Interferon-Signale, die in Abwesenheit einer aktiven Infektion einen antiviralen Schutz bieten, sind bei allen Menschen kurz nach der Geburt vorhanden.
Diese schützende Antwort entsteht durch Immunzellen, die sich in den Wänden des
Bacteroides fragilis, welches in der Mehrzahl der menschlichen Eingeweide vorkommt, initiiert eine Signalkaskade, die Immunzellen im Dickdarm veranlasst, ein Protein namens Interferon-beta freizusetzen
Eines dieser Mikroben, Bacteroides fragilis, welches in der Mehrzahl der menschlichen Eingeweide vorkommt, initiiert eine Signalkaskade, die Immunzellen im Dickdarm veranlasst, ein Protein namens Interferon-beta freizusetzen. Diese wichtige Immunchemikalie verleiht einen antiviralen Schutz, indem sie virusinfizierte Zellen zur Selbstzerstörung veranlasst, und sie stimuliert auch andere Klassen von Immunzellen, das Virus anzugreifen.
Ein Molekül auf der Oberfläche des Bakteriums löst die Freisetzung von Interferon-beta aus, indem es den sogenannten TLR4-TRIF-Signalweg aktiviert; ein Immunsignalweg, der durch einen der neun Toll-like-Rezeptoren (TLR), die Teil des angeborenen Immunsystems sind, initiiert wird.
Dieses spezifische Oberflächenmolekül, das diese Kaskade freisetzt, ist auf mehreren anderen Darmbakterien derselben Familie vorhanden. Eine Ergänzung mit diesem kommensalen mikrobiellen Molekül war ausreichend, um die Schutzwirkung der gesamten Mikrobiota bei Tieren mit verarmter Darmmikrobiota wiederherzustellen 14Commensal Microbiota Modulation of Natural Resistance to Virus Infection, Kailyn L. Stefan, Myoungjoo V. Kim, Akiko Iwasaki, Dennis L. Kasper, Published:November 18, 2020DOI:https://doi.org/10.1016/j.cell.2020.10.047 | Antiviral Defense from the Gut, Study looks at gut bacteria role in resistance to viral infections, By EKATERINA PESHEVA November 18, Harvard Medicine School 2020 Research
Der SARS-CoV-2-Bindungsrezeptor ACE2 ist bei Morbus Crohn vermindert und wird durch mikrobielle Entzündungssignale reguliert.
Zwischen 6 % und 48 % der COVID-19-Fälle weisen Verdauungsstörungen und Symptome mit oder ohne Durchfall als Hauptbeschwerden auf.15 Pan L, Mu M, Yang P, et al. Clinical
Beim Menschen fördert die Koexpression des Angiotensin-konvertierenden Enzyms 2 (ACE2) und die Transmembranprotease Serin 2 (TMPRSS2) den Eintritt von SARS-CoV-2 in Wirtszellen.16Hoffmann M, Kleine-Weber H, Schroeder S, et al. SARS-CoV-2 Cell Entry Depends on ACE2and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell 2020;181:271-280e8
Diese Andockstellen des Coronavirus finden sich in besonders hoher Dichte in den Enterozyten der Darmschleimhaut. Sie enthalten bei gesunden Menschen hohe Konzentrationen von ACE2 und des das Spikeprotein spaltenden Enzyms TMPRSS2.
Patienten mit Darmentzündungen besitzen weniger ACE2-Rezeptoren und sowohl ACE2 als auch TMPRSS2 zeigen bei ihnen eine veränderte Lokalisation in den Enterozyten. Das könnte bedeuten, dass der Darm von Patienten mit chronisch-entzündlichen Darmerkrankungen wie Morbus Crohn resistenter gegenüber Sars-CoV-2 ist als der Darm gesunder Menschen.
Die Bildung von ACE2 und TMPRSS2 auf der Zelloberfläche kann von außen beeinflusst werden. So führt eine Stimulation der Zellen über bestimmte mikrobielle Signale und Botenstoffe des Immunsystems zu einer geringeren Ausschüttung von ACE2 im Darmepithel.
Die Expression von ACE2, aber nicht von TMPRSS2-mRNA korreliert mit dem Vorhandensein von Darmmikrobiota. Wobei in verschiedenen Mausmodellen und öffentlich zugänglichen Datensätzen eine starke negative Korrelation besteht. Ob eine solche Regulierung von ACE2, über die kommensale Flora, auch bei der menschlichen IEC auftritt, muss noch bestimmt werden. Dass die Zusammensetzung der kommensalen Mikrobiota auch mit den individuellen Unterschieden in der COVID-19-Empfindlichkeit zusammenhängt, scheint wahrscheinlich.17Patankar JV, Chiriac M, Lehmann M, Kühl AA, Atreya R, Becker C, The
SARS-CoV-2 attachment receptor ACE2 is decreased in Crohn’s disease and regulated by microbialand inflammatory signaling, Gastroenterology (2020), doi: https://doi.org/10.1053/j.gastro.2020.10.021 18IDW 27.11.2020 15:18 Wo das Coronavirus im Darm andockt, Susanne Langer Kommunikation und Presse Friedrich-Alexander-Universität Erlangen-Nürnberg
Erfahren Sie mehr: Unsere Nahrung löst im Dünndarm eine Immunantwort aus (Mai 2019 Epiphanius Wenzel)
Lesen sie mehr dazu: Warum Snacks Ihrer Gesundheit schaden können (Dezember 2018, Immunologin Jenna Macciochi)
Mikrobiom und Ernährung
Unsere Nahrungsaufnahme ist durch individuelle Vorlieben und von regional- und landesspezifisch tradierten Nahrungsmitteln und Gerichten geprägt.
Die Zusammensetzung der Ernährung hat Einfluss auf das Muster der Kolonisation der an der Verdauung
Die Haupttreiber der Zusammensetzung des Mikrobioms sind die Nahrungsfasern
Diese sind vielfältig und unterscheiden sich von Darmabschnitt zu Darmabschnitt. Sie stehen in einer als Homöostase bezeichneten Dynamik des Gleichgewichts miteinander.
Selbst bei einer standardisierten Ernährung verändert sich die Darmflora von Tag zu Tag.
Die Haupttreiber der Zusammensetzung des Mikrobioms sind die Nahrungsfasern.
Darmbakterien als Baustein in der Prognose von Typ-2-Diabetes
Selbst im Tagesverlauf verändern sich Anzahl und Zusammensetzung der im Darm des
Selbst im Tagesverlauf verändern sich Anzahl und Zusammensetzung der im Darm des Menschen aktiven Bakterien. Bei Typ-2-Diabetikern jedoch gehen diese tageszeitlichen Schwankungen verloren
Auch mathematische Modelle konnten zeigen, dass diese mikrobielle Risikosignatur, die aus arrhythmischen Bakterien besteht, zur Diagnose von Diabetes mit beiträgt. Aus dem Vergleich mit Kohorten in England konnte auch in dieser Studie gezeigt werden, dass unter anderem der regionale Einfluss auf das mikrobielle Ökosystem erheblich ist. Woraus sich der Bedarf ergibt, lokal spezifische arrhythmische Risikosignaturen zu finden.
Neben Bakterien und deren Unterschieden je nach Tageszeit spielen aber noch weitere Parameter wie der Body-Mass-Index eine Rolle, um ein späteres Erkranken einer Person besser vorhersagen zu können.19 Darmbakterien verbessern Prognose von Typ-2-Diabetes, Dr. Ulrich Marsch Corporate Communications Center, Technische Universität München. Die Arbeit wurde im Rahmen eines Sonderforschungsbereichs der Deutschen Forschungsgemeinschaft (DFG SFB1371; https://www.sfb1371.tum.de/) und mit Mitteln des Bundesministeriums für Bildung und Forschung (BMBF/JPI DINAMIC) durchgeführt.
In das Fettgewebe migrierte Bakterien sind mit Entzündungen bei Fettleibigkeit und Typ-2-Diabetes (T2D) assoziiert
Forscher der Universitätsmedizin Leipzig fanden in ihren Untersuchungen im Fettgewebe lebendige Bakterien und bakterielles Erbgut (DNA), die zu Entzündungen führen können. Je mehr bakterielle DNA im Fett vorhanden ist, umso höher sind die Entzündungswerte und damit auch die Wahrscheinlichkeit, dass Stoffwechselstörungen auftreten. Insbesondere übergewichtige Personen und Patienten mit Typ-2-Diabetes sind davon betroffen.
Die bakterielle Translokation in verschiedene Organe einschließlich des menschlichen Fettgewebes aufgrund erhöhter intestinaler Permeabilität ist nach wie vor nur unzureichend verstanden. Das Vorhandensein von Bakterien ist hoch gewebespezifisch und hängt in Zusammensetzung und Menge mit der immunen Entzündungs- und Stoffwechselbelastung zusammen.
Die Studie beweist das Vorhandensein von Bakterien und bakterieller DNA in mehreren
Die Studie beweist das Vorhandensein von Bakterien und bakterieller DNA in mehreren Fettgeweben bei Adipositas und T2D
Patienten mit Typ-2-Diabetes wiesen auch eine besondere Darmflora und eine erhöhte Durchlässigkeit des Darms auf. Eine bestimmte bakterielle Zusammensetzung und Menge an Bakterien tragen vermutlich zusätzlich zu Entzündungen bei Diabetes-2-Patienten und übergewichtigen Personen bei.
Aktuelle Forschung konnte zeigen, dass das die Entzündungen auch über die Zusammensetzung der Darmbakterien und die Anwendung von Statinen beeinflusst werden können.20Bakterien aus dem Fettgewebe führen zu Entzündungen, Peggy Darius, Stabsstelle Universitätskommunikation/Medienredaktion der Universität Leipzig 14.07.2020,21Adipose tissue derived bacteria are associated with inflammation in obesity and type 2 diabetes (Aus Fettgewebe stammende Bakterien sind mit Entzündungen bei Fettleibigkeit und Typ-2-Diabetes assoziiert), Gut microbiota, Original research, Lucas Massier, Rima Chakaroun, Shirin Tabei et al. 21. April 2020.
Diätetischer Zucker bringt einen Kolonisationsfaktor in einem Darm-Symbiont von Säugetieren zum Schweigen.
Die Zusammensetzung der Darm-Mikrobiota wird weitgehend durch Umweltfaktoren wie die Wirtsdiät bestimmt. Es wird angenommen, dass Nahrungsbestandteile die Zusammensetzung der Darm-Mikrobiota beeinflussen, indem sie als Nährstoffe für eine Teilmenge von Mikroben dienen und so deren Expansion begünstigen.
Diätzucker, die der Aufnahme durch den Wirt im Dünndarm entgehen und die Mikrobiota erreichen führen dort zu regulatorischen Effekten.
Diätetische Fruktose und Glukose, die in der westlichen Ernährung weit verbreitet sind,
Diätetische Fruktose und Glukose bringen im Mikrobiom ein spezifisches Protein zum Schweigen, das für die Darmkolonisation im Kommensal Bacteroides Thetaiotaomicron notwendig ist; eine nützliche Mikroben wird dadurch beschränkt
Die Stilllegung durch Fructose und Glucose erfordert die führende Region 5′ der mRNA, die das Protein spezifiziert, das als Roc für die Regulierung der Kolonisation bezeichnet wird.
Die Inkorporation der roc-leader-mRNA vor einem heterologen Gen reichte aus, damit Fructose und Glucose die Expression des entsprechenden Proteins ausschalten konnten.
Ein technischer Stamm, der auf Roc-Silencing durch diese Zucker widerstandsfähig ist, übertraf den Wildtyp B. Thetaiotaomikron bei Mäusen, die mit einer Ernährung gefüttert wurden, die reich an Glukose und Saccharose (ein Disaccharid, das aus Glukose und Fruktose besteht) ist, aber nicht bei Mäusen, die mit einer komplexen polysaccharidreichen Ernährung gefüttert wurden.
Bacteroides thetaiotaomicron
Bacteroides thetaiotaomicron gehört zur normalen Bakterien-Flora des Menschen und
Bacteroides thetaiotaomicron gehört zur normalen Bakterien-Flora des Menschen und dominiert diese sogar. Die vom Genom codierten Proteine ermöglichen das Aufnehmen von sonst unverdaulichen Polysacchariden und deren Hydrolyse.
Bacteroides thetaiotamicron ist eine Bakterienart aus der Gattung Bacteroides und ist wie alle Spezies in dieser Gattung gramnegativ, obligat anaerob und nicht sporenbildend. Es dominiert die Darmflora der meisten Säugetiere.
Die vom Genom codierten Proteine ermöglichen das Aufnehmen von sonst unverdaulichen Polysacchariden und deren Hydrolyse.
Es stellt dabei dem Wirt gleichzeitig metabolische Fähigkeiten zur Verfügung, die dessen Genom nicht zulässt.
Die Glycosylhydrolasen und Kohlenhydrat-bindenden Proteine auf der Zelloberfläche beziehungsweise im Periplasma der äußeren Zellmembran führen zu der Fähigkeit, auf äußere Signale der Umgebung durch Signaltransduktion zu reagieren.
Dies ergibt einen Vorteil gegenüber anderen Organismen in der Darmflora, die diese Fähigkeit nicht besitzen.
Des Weiteren ist das Bakterium fähig, im Wirtsorganismus die Angiogenese während der
Diese hoch entwickelten Strategien von B. thetaiotaomicron bestehen in der Wahrnehmung seiner örtlichen Umgebung, der Verstoffwechselung von Polysacchariden, sowie der Manipulation der Genexpression des Wirtes, die zu einer beidseitig vorteilhaften Symbiose führen.
Durch die Manipulation der Genexpression beim Wirt ist es in der Lage, beispielsweise die Synthese von verschiedenen Glykanen des Darmepithels zu beeinflussen, einschließlich derer, die eine terminal alpha-verlinkte Fucose besitzen und dadurch von seinen eigenen alpha-Fucosidasen abgeerntet werden können.
Dies geschieht jedoch nur dann, wenn B. thetaiotaomicron einen nicht ausreichenden Fucosespiegel in seiner Umgebung wahrnimmt und so sein eigenes Überleben sichern muss.
Das so induzierte Vorhandensein von Nährstoffen nutzen andere Organismen ebenfalls aus, wobei sich alle Darmbakterien auch stets durch Tarnung vor der adaptiven Immunantwort des Wirtes schützen müssen.
Zusammenfassend bestehen diese hoch entwickelten Strategien von B. thetaiotaomicron in der Wahrnehmung seiner örtlichen Umgebung, der Verstoffwechselung von Polysacchariden, sowie der Manipulation der Genexpression des Wirtes, die zu einer beidseitig vorteilhaften Symbiose führen.
Mikrobielle Stickstofflimitierung im Dickdarm von Säugetieren
Mikrobiota besetzen einen Lebensraum der in Bezug auf die Stickstoffversorgung im
Mikrobiota besetzen einen Lebensraum der in Bezug auf die Stickstoffversorgung im Dickdarm begrenzt ist
Stickstoff wird von allen Lebewesen benötigt, da er Bestandteil von Aminosäuren in Proteinen, von Nukleinsäuren und von anderen essenziellen chemischen Stoffen der Lebewesen ist.
Lebewesen nehmen deshalb bei ihrem Wachstum Stickstoff aus der Umgebung auf (Stickstoff-Assimilation) und er wird nach ihrem Absterben aus der toten Biomasse wieder
Alle Lebewesen nehmen bei ihrem Wachstum Stickstoff aus der Umgebung auf (Stickstoff-Assimilation) und er wird nach ihrem Absterben aus der toten Biomasse wieder freigesetzt
Lebewesen sind so ein bedeutender Faktor im Kreislauf des Stickstoffs im Darm wie in den Oberflächenschichten der Erde.
Dass dieser Kreislauf trotz seiner Engpässe funktioniert, zeigen Stoffbilanzen und Abschätzungen. Demnach wurde der verfügbare Stickstoff während der Erdgeschichte im Durchschnitt schon 900- bis 1000-mal von Lebewesen in ihren Körper eingebaut und wieder ausgeschieden.
Bei Mäusen reduziert die Senkung des Proteingehalts der Nahrung die Konzentration von
So wurde der verfügbare Stickstoff während der Erdgeschichte im Durchschnitt schon 900- bis 1000-mal von Lebewesen in ihren Körper eingebaut und wieder ausgeschieden
Die intestinale Stickstoffbegrenzung resultiert aus der Aufnahme und bevorzugten Verwendung von Nahrungsnährstoffen durch den Wirt.
Proteinreiche Nahrung ist gleichbedeutend mit hohem Stickstoffangebot im Darm.
Mitglieder des Stammes Bacteroidetes konsumieren im Dickdarm leichter Stickstoff als andere kommensale Taxa. Zu den anaeroben Bacteroideten zählt z. B. die Gattung Bacteroides, die im menschlichen Darm die mit 1011 Zellen pro Gramm häufigsten Bakterien
Proteinreiche Nahrung ist gleichbedeutend mit hohem Stickstoffangebot im Darm
Es sind aber auch aerobe (auf Sauerstoff angewiesene) Vertreter vorhanden. Einige sind pathogen. Die Zellen der meisten Bacteroidetes Arten sind stäbchenförmig und bilden keine Sporen. Sie bilden einen eigenen Stamm innerhalb der Domäne der Bakterien. In diesem Phylum findet sich eine breite Vielfalt von Stoffwechsel, Ökologie und Morphologie.
Diese Ressourcenbeschränkung erlaubt es den Wirten im Prinzip, die mikrobiellen Gemeinschaften im Dickdarm zu regulieren.
Die kommensale Mikrobiota kann sich an Stickstoff-begrenzte Umgebungen angepasst haben. Dies würde auf einen Grund hindeutet, warum überschüssiges Nahrungsprotein mit geschädigten darmmikrobiellen Ökosystemen in Verbindung gebracht wird.
Lesen Sie dazu: Über die toxischen Wirkungen künstlicher Süßstoffe auf Darmbakterien (Oktober 2018 , Epiphanius Wenzel)
Ballaststoffe, gute Mikroben, SCFAs, Butyrat, Mikroglia, Succinat und Propionat
Ballaststoffreiche Diäten begünstigen gute Mikroben, während fettreiche und proteinreiche Diäten einen negativen Einfluss auf die mikrobielle Zusammensetzung und Funktion haben können.
Mit zunehmendem Alter der Säugetiere entzünden sich die Immunzellen im Gehirn, die als
Ballaststoffreiche Diäten begünstigen gute Mikroben, während fettreiche und proteinreiche Diäten einen negativen Einfluss auf die mikrobielle Zusammensetzung und Funktion haben können
Wenn Bakterien Ballaststoffe verdauen, produzieren sie kurzkettige Fettsäuren (SCFAs), einschließlich Butyrat, als Nebenprodukte.
Butyrat ist von Interesse, da es nachweislich entzündungshemmende Eigenschaften auf die Mikroglia hat und das Gedächtnis bei Mäusen verbessert.
Butyrat hemmt die Produktion schädlicher Chemikalien durch entzündete Mikroglia. Eine dieser Chemikalien ist Interleukin-1β, das mit der Alzheimer-Krankheit beim Menschen in
Wenn Bakterien Ballaststoffe verdauen, produzieren sie kurzkettige Fettsäuren (SCFAs), einschließlich Butyrat, als Nebenprodukte. Butyrat ist von Interesse, da es nachweislich entzündungshemmende Eigenschaften auf die Mikroglia hat und das Gedächtnis bei Mäusen verbessert
Gruppen von jungen und alten Mäusen bekamen eine ballaststoffarme und eine ballaststoffreiche Ernährung.
Butyrat und andere SCFAs im Blut zeigten sich in der letzteren Gruppe für junge als auch für alte Mäuse erhöht und die Darmentzündung der alten Mäuse dramatisch reduziert.
Junge Mäuse hatten auch bei ballaststoffarmer Kost keine Inflammationen im Darm.
Anhand von 50 einzigartigen Genen der Mikroglia sahen die Forscher auch das Entzündungsprofil im Gehirn der älteren Tieren reduziert.
„Die Stoffwechselprodukte der Ballaststoffe, insbesondere Butyrat, können auf diese Weise auch zur Verminderung der Krebsentstehung in jedem Teil des Körpers beitragen.
Butyrat, eine kurzkettige Fettsäure, die als Kraftstoffquelle für die Zellen dient, die den Dickdarm auskleiden, erleichtert die Apoptose von Darmkrebszellen und reduziert Darm- und Gehirn-Entzündungen.
Lesen Sie mehr dazu: Die Verwendung von mikrobiell zugänglichen und fermentierbaren Kohlenhydraten und/oder Butyrat als unterstützende Behandlung für Patienten mit Coronavirus SARS-CoV-2-Infektion
Lesen Sie mehr dazu: Neue Hinweise für den Zusammenhang zwischen Darmbakterien und neurodegenerativen Erkrankungen Die Besiedlung des Darms von Caenorhabditis elegans mit humanen enterischen bakteriellen Pathogenen führt zu einer Störung der Proteostase, die durch Butyrat wiederhergestellt wird.
So untersuchten Forscher den Zusammenhang zwischen Emotionalität, Depression und Mikrobiom bei Laborratten. Dabei konnten sie nachweisen, dass sich bei den Ratten, die besonders ängstlich sind und ein behandlungsresistentes Depressionsverhalten haben, die Zusammensetzung des Darm-Mikrobioms stark von normalen, nicht-ängstlichen Tieren unterschied.
Wurden die ängstlichen Tiere mit dem Antibiotikum Minozyklin behandelt, wurde nicht nur die Darmflora erwartungsgemäß stark verändert. Die Tiere verhielten sich auch aktiver und zeigen weniger Depressions-ähnliches Verhalten.
Minocyclin erhöhte deutlich die relative Häufigkeit von Lachnospiraceae und Clostridiales Familie XIII. Familien, die für ihre Butyratproduktion bekannt sind, mit einer entsprechenden Zunahme und positiven Korrelation der 3-OH-Butyratspiegel im Plasma.
Butyrat kann die Aktivierung von Mikroglia im Gehirn verhindern, also entzündungshemmend wirken. Der antidepressive Effekt von Minozyklin ist mit großer Wahrscheinlichkeit auf diese Wirkung zurückzuführen.
Diese Ergebnisse unterstützen die Mikrobiom-Hirn-Achse als potenzielles Ziel bei der Behandlung von Depressionen. 22Entzündung im Hirn. Wie ein Antibiotikum Depressions-Verhalten vermindert Ärzte Zeitung online 19.09.2019 23Minocycline alters behavior microglia and the gut microbiome in a trait-anxiety-dependent manner Minocyclin
Leguminosen oder Hülsenfrüchte, zu denen Bohnen, Kichererbsen und Linsen gehören, sind eine gute Quelle für Proteine und Ballaststoffe und eine besonders unzureichend genutzte Nahrungsquelle.” (Rita Rubin, MA JAMA Network April 2019, en)
Des Weiteren begrenzt ein Nebenprodukt, welches die Mikroben beim Abbau von Tryptophan in der Nahrung produzieren, die Entzündung im Gehirn durch ihren Einfluss auf die Mikroglia.
Der Verzehr von weißen Champignons kann die Mikroben-Gemeinschaft im Darm so verändern, dass durch deren Stoffwechsel-Produkte die Leber den Glukosespiegel besser regulieren kann.
Wenn weiße Champignons an Mäuse verfüttert werden, bewirkt dies, dass sich bei ihnen die
Der Verzehr von weißen Champignons kann die Mikroben-Gemeinschaft im Darm so verändern, dass durch deren Stoffwechsel-Produkte die Leber den Glukosespiegel besser regulieren kann
Succinat und Propionat beeinflussen die Expression von Genen, die die Glukoseproduktion steuern, positiv.
Für den Menschen wäre eine tägliche Portionsgröße von 85 Gramm weißen Champignons wirksam.
Die Champignons dienen in diesem Fall als Präbiotikum, das heißt, als eine Substanz, die nützliche, im Darm vorhandene, Bakterien ernährt.
Propionat/Propionsäure
Propionsäure ist der Trivialname der Propansäure, einer Carbonsäure mit stechendem
Bakterien, die Propionsäure bilden, wie beispielsweise Clostridien und Prevotella, besiedeln den Dickdarm des Menschen. Sie bilden dort die Säure aus unverdauten Kohlenhydraten
Bakterien, die Propionsäure bilden, wie beispielsweise Clostridien und Prevotella, besiedeln den Dickdarm des Menschen. Sie bilden dort die Säure aus unverdauten Kohlenhydraten. Auch bei der Herstellung bestimmter Käse ist die Bildung von Propionsäure durch bestimmte Bakterien von Bedeutung. Propionsäurebakterien im Käsebruch bilden beim Emmentaler und anderen Hartkäsesorten die charakteristischen Löcher und das Aroma durch Freisetzung von Kohlenstoffdioxid und Propionsäure.
Nehmen Menschen eine ballaststoffreiche Diät zu sich, so ändert sich nach einigen Monaten die Zusammensetzung der Bakterien im Darm und es werden mehr kurzkettige Fettsäuren gebildet.
Vollkornprodukte und Früchte enthalten zum Beispiel Fasern aus Zellulose und Inulin. Unter anderem daraus stellen Darmbakterien nützliche Moleküle her, wie die kurzkettige Fettsäure Propionsäure, deren Rückgrat aus nur drei Kohlenstoffatomen besteht.
Die Substanz wird seit Jahrhunderten benutzt. Propionsäure (E 280) sowie ihre Salze Natriumpropionat (E 281), Calciumpropionat (E 282) und Kaliumpropionat (E 283) werden als Konservierungsmittel verwendet. Die Säure selbst hat einen für den Menschen unangenehmen Geschmack, deshalb werden in der Lebensmittelindustrie, vor allem für abgepacktes Schnittbrot oder Feingebäck, die Salze der Säure verwendet.
Forscher verfütterten Propionsäure an Mäuse mit erhöhtem Blutdruck. Die Tiere hatten
Propionsäure wirkt gegen ein Spektrum an bluthochdruckbedingten Schädigungen des Herz-Kreislaufsystems
Schalteten die Forscherinnen und Forscher jedoch einen bestimmten Subtyp der T-Zellen, die
Propionsäure wirkt auf dem Umweg über das Immunsystem auf Herz und Gefäße ein. Insbesondere jene T-Helferzellen, die entzündliche Prozesse befeuern und Bluthochdruck mitverursachen, würden von ihr beruhigt
Die Substanz wirkt auf dem Umweg über das Immunsystem auf Herz und Gefäße ein. Insbesondere jene T-Helferzellen, die entzündliche Prozesse befeuern und Bluthochdruck mitverursachen, würden so beruhigt.
Die Fettsäure Propionsäure schützt also vor den Folgen von Bluthochdruck wie Atherosklerose oder Gewebeumbau des Herzens, wie die Studie an Mäusen zeigt. Darmbakterien stellen die Substanz aus natürlichen Ballaststoffen her. Sie beruhigt jene Immunzellen, die den Blutdruck in die Höhe treiben.
Untersuchungen an Zelllinien von Dünn- und Dickdarmzellen haben gezeigt, dass die
Die Stimulierung der G-Protein-gekoppelten Rezeptoren für kurzkettige Fettsäuren GRP41 und GRP43 durch Propionsäure führt zu einer günstigen Beeinflussung des Fett- und Zuckerstoffwechsel
Besonders die vermehrte Bildung von zwei Hormonen, PYY (Peptid YY) und GLP-1 (Glucagon-like Peptide 1) ist in diesem Zusammenhang wichtig. PYY und GLP-1 werden in den „L-Zellen“ des Darms, besonders im letzten Teil des Dünndarms (Ileum) und im Dickdarm (Blinddarm, aufsteigender Dickdarm) produziert. GLP-1 aktiviert die Insulinproduktion in der Bauchspeicheldrüse und hemmt dort gleichzeitig die Glucagon-Bildung (Glucagon ist der Insulin-Gegenspieler und erhöht den Blutzuckerspiegel). Somit wird durch kurzkettige
Besonders die vermehrte Bildung von zwei Hormonen, PYY (Peptid YY) und GLP-1 (Glucagon-like Peptide 1) ist in diesem Zusammenhang wichtig. GLP-1 aktiviert die Insulinproduktion in der Bauchspeicheldrüse und hemmt dort gleichzeitig die Glucagon-Bildung
Gleichzeitig wird der Appetit reduziert und das Sättigungsgefühl verstärkt. Dabei wirken PYY und GLP-1 sowohl im Hypothalamus, einer bestimmten Gehirnregion, im Sinne eines Sättigungsgefühls sowie einer Verminderung des Appetits, als auch im Magen, wo die Entleerung gehemmt wird.
Wird Propionsäure in Form von Natriumpropionat oder Calciumpropionat der Nahrung zugeführt, hat dies eine Produktion von PYY und GLP-1 zur Folge, deren Spiegel im Blut ansteigen. Im Laufe eines halben Jahres kommt es bei Übergewichtigen zu einer Gewichtsabnahme, auch im Bauchraum und der Leber, und die Insulinresistenz, die sich in der Kontrollgruppe verschlechtert, bleibt gleich.
Propionsäure wird also bei ballaststoffreicher Ernährung durch Bakterien im Dickdarm gebildet und stellt dann eine der wichtigsten Energiequellen der oberflächlich gelegenen Darmzellen (Darmepithelien) dar.
Die Epithelzellen des Dickdarms nehmen fast 90 % der kurzkettigen Fettsäuren auf und geben sie über das Pfortadersystem und die Leber an den Organismus weiter. Aktuellen Schätzungen zufolge bezieht der Mensch bis zu zehn Prozent seines täglichen Energiebedarfs über die kurzkettigen Fettsäuren. Darüber hinaus decken die Epithelien des Dickdarms über die Hälfte ihres Energiebedarfs aus kurzkettigen Fettsäuren, insbesondere auch über die Buttersäure.
Eine Reihe von Zellen haben auf ihrer Oberfläche Rezeptoren, mit denen sie kurzkettige
Die Epithelzellen des Dickdarms nehmen fast 90 % der kurzkettigen Fettsäuren auf und geben sie über das Pfortadersystem und die Leber an den Organismus weiter
GPR41 findet sich in Zellen von Fettgewebe, Bauchspeicheldrüse, Milz, Lymphknoten, Knochenmark, Lymphozyten und Monozyten. GPR43 findet sich im distales Ileum, Colon, Fettgewebe, Monozyten und neutrophile Granulozyten (höchste Expression). Dementsprechend sind die Effekte von Propionsäure und ihren Salzen, wie Natriumpropionat, und anderen kurzkettigen Fettsäuren speziell auf den Zucker- und Fettstoffwechsel sowie das Immunsystem ins Zentrum der aktuellen Forschung geraten.
So übt die Propionsäure wie andere kurzkettige Fettsäuren einen regulierenden Einfluss auf die Entzündungsbereitschaft des Darmes sowie des gesamten Organismus aus und kann im Tierversuch chronischen Entzündungskrankheiten, wie etwa der Multiplen Sklerose, vorbeugen.
Zudem stimuliert Propionsäure bestimmte neuroendokrine Zellen des Dickdarmes, die sogenannten L-Zellen, zur Produktion von Hormonen (Glucagon-like Peptide 1, Peptide YY), die sich günstig auf Fettleibigkeit und Diabetes auswirken.
Allerdings zeigten Tirosh et al. 2019-04 in einer Studie, dass der Verzehr einer 1000 mg Propionat enthaltenden Mischmahlzeit beim Menschen kurz nach dem Essen zu einem signifikanten postprandialen Anstieg von Plasma-Glucagon, einem glukoneogenen Hormon namens Fettsäure-bindendes Protein 4 (FABP4) und zur Noradrenalinfreisetzung durch das sympathische Nervensystem führte. Dies wiederum bewirkte eine Insulinresistenz mit kompensatorischer Hyperinsulinämie. Die Ergebnisse deuten darauf hin, dass Propionat auch als Stoffwechseldisruptor wirken kann, der das Risiko für Diabetes und Fettleibigkeit beim Menschen potenziell erhöht.
Kurzkettigen Fettsäuren normalisieren das MS-Immunsystem bei Multipler Sklerose
Propionsäure (Propansäure), die bestimmte Bakterienspezies aus Faserstoffen produzieren, regten im Tierversuch die Bildung regulatorischer T-Zellen im Darm an, was wiederum in einem Tiermodell der Multiplen Sklerose die Remyelinisierung von Nervenzellen begünstigte.
In einer Studie der Neurologischen Universitätsklinik in Bochum wurden von Professor Aiden Haghikias Arbeitsgruppe MS-Patienten mit zweimal täglich 500 mg peroralem Propionat behandelt – zusätzlich zur herkömmlichen Pharmakotherapie. Unter der durchschnittlich fast vier Jahre andauernden Behandlung kam es zu einem deutlichen Anstieg der regulatorischen T-Zellen der Patienten.
Auf immunzellulärer Ebene hatte sich bereits nach 1–2 Wochen die bei MS-Patienten eingeschränkte Mitochondrienfunktion und so die Bereitstellung von Stoffwechselenergie normalisiert. Womöglich sei das einer der entscheidenden Schlüsselmechanismen für die vermuteten neuroprotektiven und remyelinisierenden Effekte der SFCA.
Viele MS-Patienten erlebten, dass unter der Propionsäure-Behandlung ihre krankheitsassoziierte Fatigue deutlich zurückgehe. Die Schubrate war unter Propionsäure im Vergleich zur alleinigen Standardbehandlung um die Hälfte vermindert und die Behinderungsprogression signifikant niedriger. Im MRT zeigte sich unter Propionat sogar eine signifikante Volumenzunahme im Bereich der Basalganglien. Durch Liquoruntersuchungen habe man zudem verifiziert, dass sich die oral aufgenommene Propionsäure auch tatsächlich im zentralen Nervensystem anreichert. 24Mit kurzkettigen Fettsäuren das MS-Immunsystem normalisieren Ärztezeitung, 11.11.2019 Dr. Thomas Heim
Ballaststoffreiche Ernährung als Zusatzbehandlung für Arthritis und der Zonulin-Faktor
Ballaststoffe haben Einfluss auf die Zusammensetzung der Darmflora. Eine gesunde
Ballaststoffe haben Einfluss auf die Zusammensetzung der Darmflora. Eine gesunde Darmflora stellt größere Mengen an kurzkettigen Fettsäuren her. Diese kurzkettigen Fettsäuren wirken sich positiv auf entzündliche Erkrankungen wie die Rheumatoide Arthritis aus
Eine weitere Studie des Teams um Prof. Dr. Mario Zaiss, Professur für Immuntoleranz und Autoimmunität der FAU, stützt diese Ergebnisse.26Targeting zonulin and intestinal epithelial barrier function to prevent onset of arthritis https://www.nature.com/articles/s41467-020-15831-7 (Beeinflussung der Funktion von Zonulin und der epithelialen Barrierefunktion des Darms zur Verhinderung des Ausbruchs von Arthritis) Das Darmepithel, also das Deckgewebe – die Ummantelung – des Darms, schüttet bei einer gestörten Bakterienbesiedlung vermehrt Zonulin aus. Zonulin sorgt dafür, dass die sogenannten Tight Junctions – das sind Proteine, die die Zellzwischenräume der Darmummantelung abdichten – durchlässig werden, zum Beispiel für Peptide oder Teile von Bakterien. Die Bakterienbruchstücke ähneln menschlichen Körperbestandteilen, weshalb, so vermuten die FAU-Forschenden, der Organismus nicht zwischen den Fremdstoffen und eigenen Körperzellen unterscheiden kann. Er greift die Eindringlinge an und bildet Antikörper, die sich zugleich gegen eigene Körperzellen richten. Die Folge sind autoimmun bedingte Entzündungsreaktionen und zugleich der Startschuss für die Krankheitsaktivität bei Rheumatoider Arthritis.
Da die Forschenden die positiven Wirkungen der kurzkettigen Fettsäure Butyrat auf die Rheumatoide Arthritis bereits aus ihrer vorhergehenden Studie kannten, verabreichten sie auch in der Zonulin-Studie Mäusen Butyrat. Es zeigte sich, dass diese Behandlung den Beginn der Arthritis verzögerte, die Zonulin-Konzentration senkte und die intestinale Barriere stärkte. Eine noch stärkere Wirkung erzielten sie mit der Gabe von Larazotid-Acetat, einem Stoff, der bereits in klinischen Studien zur Behandlung von Zöliakie, also Glutenunverträglichkeit verwendet wird. Unter Larazotid-Acetat, das die Zonulin-Produktion hemmt, ging die Entzündungstätigkeit in den Gelenken zurück, die Knochenfestigkeit stieg an und der Beginn der Arthritis ließ sich hinauszögern.
Die Wissenschaftler der FAU gehen davon aus, dass sich auch bei Menschen die Krankheitsaktivität bei Arthritis durch eine Blockade der Zonulin-Produktion mit Larazotid-Acetat verzögern lassen kann. Da die Substanz bereits in Phase-III-Studien getestet wird, ist ein Einsatz für Rheumatoide Arthritis demnächst unter Umständen ebenfalls möglich.27Dieser Abschnitt zitiert ausgiebig aus der Pressemitteilung:Ballaststoffreiche Ernährung als Zusatzbehandlung für Arthritis? von Susanne Langer Kommunikation und Presse, Friedrich-Alexander-Universität Erlangen-Nürnberg
Chronisch entzündliche Darmerkrankungen
Bei chronisch entzündlichen Darmerkrankungen gerät auch die Zusammensetzung des Mikrobioms aus der Balance. Hier finden sich im Darmmikrobiom im Vergleich zu Gesunden weniger Bakterienarten. Neuere Untersuchungen zeigten zudem, dass bei dieser Pathologie das Enzym Hexokinase 2 erhöht ist. Hohe Spiegel von HK2 in Darmzellen zeigen einen ungesunden Zustand an. Hexokinasen katalysieren den ersten Schritt der Glykolyse und begrenzen deren Tempo. HK2 wird im Darmepithel stark exprimiert, trägt zur Immunantwort bei und wird bei Entzündungen hochreguliert.
Im Tiermodell wurden durch Gabe der kurzkettigen Fettsäure Butyrat die HK2-Spiegel in Darmepithelzellen erniedrigt und die Entzündungen gehemmt. Butyrat unterdrückte die HK2-Expression über die Histon-Deacetylase 8 (HDAC8) und reduzierte die mitochondriale Atmung. Zwei von Bakterien im Darm erzeugte Stoffwechselprodukte wirken regulierend auf die Produktion von HK2 ein: die kurzkettigen Fettsäuren Acetat und Butyrat. Diese Fettsäuren werden nicht mit der Nahrung aufgenommen, sondern von ganz bestimmten Darmbakterien produziert. Acetat erhöhte die Konzentration von HK2 in den Darmzellen, während Butyrat die HK2-Spiegel erniedrigte.
Dass die kurzkettige Fettsäure Butyrat, auch Buttersäure genannt, die Darmbarriere stabilisiert und antientzündlich wirkt, ist bereits aus vielen früheren Studien bekannt. Einem therapeutischen Einsatz etwa bei chronisch entzündlichen Darmerkrankungen steht jedoch der sehr unangenehme Geruch von Butyrat sowie seine stark abführende Wirkung entgegen. Theoretisch wäre es auch denkbar, das Darmmikrobiom durch Gabe von fettsäureproduzierenden Bakterien und mittels ballaststoffreicher Ernährung aufzubauen oder einen medikamentösen Ansatz für die Verminderung der HK2-Spiegel zu finden. 28Hinrichsen F, Hamm J, Westermann M, … Rosenstiel P, Sommer F. Microbial regulation of hexokinase 2 links mitochondrial metabolism and cell death in colitis. Cell Metabolism (2021
https://doi.org/10.1016/j.cmet.2021.11.004 Precision Medicine in Chronic Inflammation
Tradiertes Mikrobiom, Fast-Food-Mikrobiom, Sporenbildung
Die Ernährung beeinflusst das Mikrobiom über Generationen hinweg. Eine gesunde Darmflora ist artenreich. Eine abwechslungsreiche Ernährung mit vielen Ballaststoffen fördert die Bakterienvielfalt.
Die typisch westliche Kost geht mit einer artenarmen Darmflora einher. Fast-Food-Eltern
Fast-Food-Eltern geben ihre verkümmerte Darmflora an ihre Kinder weiter. Dieser Verlust an Diversität lässt sich nicht ohne Weiteres beheben
Die Darmbakterien sind auch im Labor kultivierbar. Über die Hälfte der gefundenen Arten bildet widerstandsfähige Sporen. Dies bedeutet, dass sie sich leicht von Mensch zu Mensch übertragen lassen. Etwa durch ein Händeschütteln oder von einem Haltegriff bei der abendlichen Heimfahrt mit dem Bus.
Darm-Mikrobiom und vaginaler Mikrobentransfer
Per Kaiserschnitt geboren Kinder haben ein anderes Darm-Mikrobiom als Babys, die auf natürlichem Weg zur Welt kommen. Es besteht überwiegend aus Bakterien die sich auf
Diese Entwicklungsstörung der Darmflora wird für die erhöhte Rate von allergischen Erkrankungen, Asthma, Gewichtsproblemen und anderen Störungen der von per Sectio caesarea geborenen Kindern als Ursache vermutet
Diese Entwicklungsstörung der Darmflora wird für die erhöhte Rate von allergischen Erkrankungen, Asthma, Gewichtsproblemen und anderen Störungen der von per Sectio caesarea geborenen Kindern als Ursache vermutet. Sie kann teilweise durch einen vaginalen Mikrobentransfer behoben werden.
Bei normal geborenen Kindern gleicht die Darmflora jener der Mutter. Das Kind schluckt im Geburtskanal Vaginalsekret. Das vaginale Mikrobiom und das der Darmflora sind sehr ähnlich.
In der Geburtshilfe reibt man die Kaiser-Schnitt-Kinder nun manchmal mit dem Vaginalsekret der Mutter ein. Auch wird ihnen etwas davon in den Mund getropft. Vaginal Seeding nennt sich diese Prozedur auch.
Stuhl-Mikrobiom und gastrointestinales Mikrobiom
Für ein Vergleich von Stuhl-Mikrobiom mit dem innerlich gewonnenen wurde auch das gastrointestinale Mikrobiom der menschlichen Schleimhaut metagenomisch charakterisiert.
Dabei zeigte es sich, dass es nur teilweise mit dem Stuhl-Mikrobiom übereinstimmt. Fast alle Forschung am Mikrobiom erfolgte bislang über die im Stuhl vorgefundenen Mikroorganismen.
Probiotika als Lebensmittel, Kolonisations-Muster
Auch gesunde Menschen konsumieren Probiotika. Sie erhoffen sich mehr Lebensqualität und mehr Widerstandskraft gegen Krankheiten. Das Mikrobiom unseres Darmes spielt eine große Rolle für die Gesundheit.
Probiotika werden in Kapselform oder als Lebensmitteln wie Joghurt, Kefir, Buttermilch, Kimchi oder Sauerkraut, aufgenommen.
Der Nachweis der Wirksamkeit der probiotischen Besiedlung der Darmschleimhaut bleibt spärlich und umstritten. So zeigten sich In einer Versuchsgruppe, die Probiotika erhielt, zwei verschieden Reaktionsmuster.
Eines widersetzte sich der Kolonisation des Bioms der Probiotika, ein anderes nahm die
Menschen zeichnen sich durch eine individuelle Resistenz der Darmschleimhaut gegenüber der Kolonisation durch das Mikrobiom von Probiotika aus. Bei einem Teil scheint die Zufuhr von Probiotika nutzlos zu sein
Menschen zeichnen sich durch eine individuelle Resistenz der Darmschleimhaut gegenüber der Kolonisation durch das Mikrobiom von Probiotika aus. Bei einem Teil scheint die Zufuhr von Probiotika nutzlos zu sein. Die Befunde entkräften aber die Vermutung, dass das Biom der Probiotika bei einer Magen-Darm-Passage nicht lebensfähig bliebe.
Die Ansiedlung von Probiotika-Bakterien im Darm ist abhängig von den bestehenden Mustern der Kolonisation bei der Person. Es zeigen sich darin regionale und stammes-spezifische Muster der Zusammensetzung in der Darmschleimhaut des Menschen.
Bei den empfänglichen Personen haben die verabreichten Probiotika nur temporär und individuell Einfluss auf die Gemeinschaftsstruktur der Darmschleimhaut und des Darm-Transkriptom.
Nicht alle Mechanismen, die probiotische Stämme zur Koloniebildung nutzen können sind bekannt. Der größte Teil des menschlichen Immunsystems findet sich im Magen-Darm-Trakt. Die Ansiedlung gesunder Bakterien steht im Wettbewerb mit bakteriellen Krankheitserregern. Sie kann Darminfektionen verhindern und das Immunsystem dazu anregen, die pathologischen Keime zu bekämpfen. So kann der Gebrauch von Probiotika die Verschreibung von Antibiotika reduzieren.
Probiotika und Antibiotika-Therapie
Die Koloniebildung von Probiotika-Mikrobiomen im Darm ist stärker ausgeprägt, wenn die
Die Antibiotika zerstören ein Teil des Mikrobioms und seines Gleichgewichts. Dies erleichtert den Probiotika-Mikroben in diese Lücke zu treten und sich festzusetzen
Die Antibiotika zerstören ein Teil des Mikrobioms und seines Gleichgewichts. Dies erleichtert den Probiotika-Mikroben in diese Lücke zu treten und sich festzusetzen.
Diese Ansiedlung von Probiotika nach Antibiotika-Therapie erfolgt disruptiv.
Die Forscher sprechen davon, dass dies zu einer langanhaltenden schweren Störung des Darm-Mikrobioms führt.
Im Vergleich zur spontanen nach-antibiotischen Erholung bewirken Probiotika eine deutlich
Im Vergleich zur spontanen nach-antibiotischen Erholung bewirken Probiotika eine deutlich verzögerte und anhaltend unvollständige Wiederherstellung des ursprünglichen Mikrobioms
Das Gleichgewicht des eigenen Stuhl- beziehungsweise des Mukosa-Mikrobioms und des Wirts-Transkriptoms in Richtung homöostatischer Konfiguration wird deutlich verzögert.
Im Reagenzglas trugen Lactobacillus-sekretierte lösliche Faktoren zur Hemmung des probiotisch induzierten Mikrobioms bei.
Die Gabe von Probiotika nach Antibiotika-Therapie hemmte die vollständige Rückkehr des vorher vorhandenen Mikrobioms und die Wiederherstellung seines Gleichgewichts.
Die Genexpression im Darm wird dadurch ebenso gestört. Sie hält bis zu sechs Monate an.
Probiotika können das Darm-Mikrobiom eines Menschen für lange Zeit daran hindern, nach einer Antibiotika-Therapie wieder zur Normalität zurückkehren. Verschiedene Menschen reagieren hier auf Probiotika auf dramatisch unterschiedliche Weise.
Rückführung des eigenen intakten Mikrobioms nach Antibiotika-Therapie
Einigen Versuchspersonen wurde vor der Antibiotika-Therapie durch Endoskopie und Koloskopie Darm-Mikrobiom entnommen und nach der Therapie wieder eingeführt.
Sie zeigten eine schnelle und nahezu vollständige Erholung des Mikrobioms innerhalb weniger Tage
Zuviel Probiotika
Menschen, die Probiotika im Übermaß einnehmen können im Dünndarm riesige Kolonien an Lactobacillus-Bakterien aufzeigen. Diese produzieren große Mengen an D-Milchsäure. Beschwerden wie Blähbauch und Magenschmerzen, aber auch mentale Symptome wie Verwirrtheit können damit in Zusammenhang gebracht werden. Laktobacillus-Bakterien sind normalerweise nicht im Dünndarm angesiedelt.
Welchen Nutzen haben probiotische Bakterien für den Magen-Darm-Trakt?
Die Interaktion zwischen der Darmmikrobiota und dem Immunsystem ist wichtig für die Physiologie des Wirtes und die Anfälligkeit für Krankheiten, aber auch für die Wirksamkeit von z. B. Krebsimmuntherapien.
Neu ist, dass spezifische probiotische Bakterien das Darmmikrobiom formen, indem sie die B-Lymphozyten in den Peyer’schen Plaques dahingehend beeinflussen, dass sie IgA induzieren, produzieren und freisetzen, nachdem sie in die Schleimhaut des Dünn- und Dickdarms eingedrungen sind.
Immunzellen des Darms sammeln sich in den lymphatischen Geweben des Dünndarms an, die auch als „Peyer’sche Plaques bekannt“ sind und einzigartige Möglichkeiten für Interaktionen zwischen Bakterien und Immunzellen bieten. Strategien zur Veränderung der Darmmikrobiota zum Nutzen der Gesundheit können die Zufuhr von Probiotika mit der Nahrung beinhalten, also von Bakterien, die dem Wirt gesundheitliche Vorteile bieten.
Solche Versuche wurden bereits mit einigem Erfolg unternommen, und es wurden Zusammenhänge zwischen oral verabreichten Probiotika und einer verbesserten Darmgesundheit sowie einem Schutz vor Kolitis nachgewiesen. Es fehlt jedoch ein grundlegendes Verständnis dafür, wie winzige Mengen an aufgenommenen probiotischen Bakterien die Darmhomöostase verbessern können, während sie den Magen-Darm-Trakt passieren.
Eine neue Studie zeigt, dass die Immunzellen der Peyer’schen Plaques probiotische Signale, die für die Gestaltung des Mikrobioms von Dünn- und Dickdarm wichtig sind, sowohl wahrnehmen als auch weiterleiten. Die Studie zeigt, dass die Behandlung gesunder Mäuse mit Limosilactobacillus reuteri sowohl die Anzahl als auch die Stärke der Effektor-Funktionen verschiedener Untergruppen großer und kleiner B-Lymphozyten in den Peyer’schen Patches erhöht und zu einer IgA-Induktion und -Produktion in einer PD-1-abhängigen Weise führt. Infolgedessen veränderten die IgA-produzierenden B-Zellen, die die Schleimhaut besiedelten, das Mikrobiom des Darms, was die Entzündungssymptome verringerte und die Zusammensetzung der Mikrobiota in einem Colitis-Modell verbesserte.
Diese Studie ist die erste, die erklärt, wie das Probiotikum Limosilactobacillus reuteri die Darmgesundheit verbessert, auch wenn sie den Darm nicht besiedeln und nur einen kleinen und vorübergehenden Teil des gastrointestinalen Mikrobioms ausmachen.29How do probiotic bacteria benefit the intestine?30Liu, HY., Giraud, A., Seignez, C. et al; Distinct B cell subsets in Peyer’s patches convey probiotic effects by Limosilactobacillus reuteri. Microbiome 9, 198 (2021). https://doi.org/10.1186/s40168-021-01128-4… https://rdcu.be/czjai
Das Mikrobiom in Wechselwirkung mit Medikamenten
Der L-Dopa-Stoffwechsel
Die Parkinson-Krankheit ist eine lähmende neurologische Erkrankung, von der mehr als 1% der Weltbevölkerung ab 60 Jahren betroffen ist. Das Hauptmedikament zur Behandlung der Parkinson-Krankheit ist Levodopa.
Um wirksam zu sein, muss L-Dopa in das Gehirn gelangen und durch das menschliche Enzym aromatische Aminosäure-Decarboxylase (AADC) in den Neurotransmitter Dopamin umgewandelt werden. Der Magen-Darm-Trakt ist aber auch ein wichtiger Umschlagplatz für die L-Dopa-Decarboxylierung, und dieser Stoffwechsel ist problematisch, da das in der Peripherie erzeugte Dopamin die Blut-Hirn-Schranke nicht überschreiten kann und unerwünschte Nebenwirkungen verursacht.
So wird L-Dopa zusammen mit Medikamenten verabreicht, die den peripheren Stoffwechsel blockieren, darunter der AADC-Inhibitor Carbidopa. Selbst mit diesen Medikamenten erreichen bis zu 56% des L-Dopas nicht das Gehirn. Darüber hinaus sind die Wirksamkeit und die Nebenwirkungen der L-Dopa-Behandlung bei Parkinson-Patienten äußerst heterogen, und diese Variabilität ließ sich nicht vollständig durch Unterschiede im Wirts-Stoffwechsel erklären.
In einer im Juni 2019 in Science erschienen Studie „Entdeckung und Hemmung eines die Arten übergreifenden Darmbakterienpfades für den Levodopa-Stoffwechsel“ konnten Vayu Maini Rekdal et al. bedeutende Entdeckungen zu diesem L-Dopa-Stoffwechsel des Darm-Mikrobioms beitragen.
Maini Rekdal et al. fanden heraus, dass verschiedene Bakterienarten am L-Dopastoffwechsel beteiligt sind. So setzen die Tyrosindecarboxylase (TDC) des Enterococcus faecalis und die Dopamindehydroxylase (Dadh) aus Eggerthella lenta A2 sequentiell metabolisiertes L-Dopa in m-Tyramin um.
Mikrobiom-Ansiedlung
Es ist noch weitgehend unbekannt, wie sich ein Mikrobiom überhaupt etabliert und erhalten kann.
Ein Befund zeigt, das spezifische Nutzbakterien über einen molekularen Mechanismus verfügen, der die langfristige Besiedlung des Darms aktiv fördert. Im Gegensatz zu eindringenden Krankheitserregern, die vom Immunsystem angegriffen werden, laden bestimmte gute Bakterien im Darm eine Immunantwort ein, um eine robuste Darmkolonisation aufzubauen.
Das Immunsystem reagiert energisch auf mikrobielle Infektionen und ermöglicht gleichzeitig eine lebenslange Besiedlung durch das Mikrobiom.
Der Darm produziert Immunglobulin A (IgA)-Antikörper in Grammmengen, von denen angenommen wird, dass sie den Darm vor Krankheitserregern schützen.
In einer Studie mit Bacteroides fragilis, einem gemeinsamen menschlichen Komensal, schien es, dass diese Kommensalart die IgA-Haftkraft gezielt ausnutzt ihre Etablierung im Darm zu fördern.
Ein Regulationssystem in Bacteroides fragilis moduliert seine Oberflächenstruktur, um die Bindung von Immunglobulin A (IgA) in Mäusen zu fördern.
Die IgA-Antwort war erforderlich, damit B. fragilis (und andere kommensale Arten) eine Schleimhautnische besetzen konnte, die eine stabile Kolonisation des Darms durch Ausschluss von Konkurrenten vermittelt.
Die Forscher glauben, dass IgA-Antworten zusätzlich zu ihrer Rolle bei der Beseitigung von Krankheitserregern vom Mikrobiom kooptiert werden können, um eine robuste hostmikrobielle Symbiose zu schaffen.
Massive Erweiterung der Bakteriophagen-Diversität im menschlichen Darm
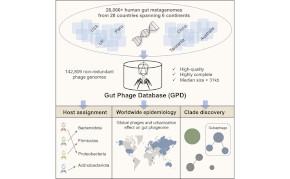
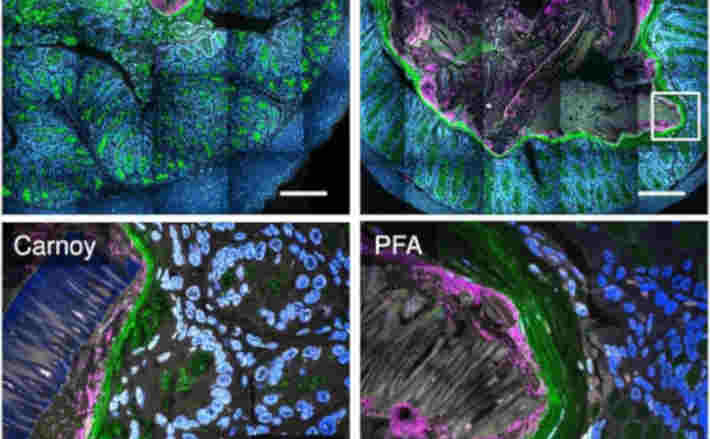
Viren sind die zahlreichsten biologischen Einheiten auf unserem Planeten
Hier lesen Sie weiter …
Stuhltransplantation
Schwere entzündliche Darminfektionen mit Clostridium difficile werden öfter mit einer sogenannten Fäkaltransplantation behandelt. Der Kranke bekommt den Stuhl und damit das Mikrobiom eines gesunden Spenders übertragen.
Die Stuhltransplantation ist auch ein bereits in Studien erprobtes Verfahren, die erhöhte Sterblichkeit von Patienten nach einer Chemotherapie, Knochenmarks-Transplantation oder einer Behandlung mit Breitspektrum-Antibiotika zu reduzieren. Die dadurch schwer geschädigte Darmflora wirkt sich negativ auf das Immunsystem und die Rekonvaleszenz aus.
Vor solchen Eingriffen sammeln die betroffenen Person Teile ihres Stuhls. Er wird eingefroren und nach der Behandlung wieder in den Darm eingespült. Dies führt zu einem schnellen Wiederaufbau einer gesunden Darmflora.
Eine Stuhltransplantation wirkt nachhaltig. Anders als Probiotika verändert sie die Darmflora dauerhaft.
Aus ärztlicher Sicht gilt zur Zeit jedoch immer noch die Einschränkung, dass abgesehen von
Eine Stuhltransplantation wirkt nachhaltig. Anders als Probiotika verändert sie die Darmflora dauerhaft
Die Stuhlspende birgt Übertragungspotenzial für Krankheiten infektiöser wie nicht-infektiöser Art. Es bedarf daher umfangreicher anamnestischer und laborchemischer Untersuchungen, die in der Regel nicht von den Krankenversicherungen übernommen werden.
Mikrobiom-Therapie: Erfolgsfaktoren für Stuhltransplantationen – Universität Hohenheim. Rückenwind für vielversprechenden Therapieansatz: Studie der Uni Hohenheim bereitet Weg für breitere klinische Anwendung der Übertragung vom Darmbakterien: https://idw-online.de/de/news799487
Fäkal-Virom-Transplantation verringert Symptome von Typ-2-Diabetes und Fettleibigkeit in einem Mausmodell
Eine Variante der Stuhltransplantation besteht experimentell auch darin, nicht das
Die Gemeinschaft der Darmviren wird von Bakteriophagen (Phagen) dominiert, das sind Viren, die Bakterien auf wirtsspezifische Weise angreifen
Die Forscher extrahierten den Kot von Mäusen, die über einen längeren Zeitraum mit einer fettarmen Standarddiät gefüttert wurden. Der Stuhl wurde dann gefiltert und alle lebenden Bakterien abgetrennt, während man die Viruspartikel – hauptsächlich Bakteriophagen – konzentrierte. Über ein Röhrchen gelangten die Viruspartikel in Mäuse, die sechs Wochen lang eine fettreiche Ernährung erhalten hatten. Diese Fäkal-Virom-Transplantation verringerte bei den fettleibigen Empfängermäusen die Symptome von Typ-2-Diabetes und Fettleibigkeit. Fettleibige Mäuse mit ungesunder Lebensweise nahmen so deutlich weniger Gewicht zu und vermieden Insulinresistenz und Typ-2-Diabetes.
Falls die Behandlung eines Tages auch für den Menschen zugänglich wird, wird diese natürlich von einer Ernährungsumstellung begleitet sein. Die Forscher sehen diesen Ansatz aber nicht auf die allgemeine Adipositas anwendbar, sondern eher nur für die schwersten Fälle. 31Rasmussen TS, Mentzel CMJ, Kot W, et al
Faecal virome transplantation decreases symptoms of type 2 diabetes and obesity in a murine model
Gut Published Online First: 12 March 2020. doi: 10.1136/gutjnl-2019-32000532CAN TRANSPLANTING POOP VIRUSES TREAT OBESITY AND DIABETES? MARIA HORNBEK-COPENHAGEN, FUTURITY 4. MAI 2020
Einen informativen Artikel gibt es hierzu auch von der FAZ: „DARMENTZÜNDUNG: Fremde Flora für den Notfall“ VON GEORG RÜSCHEMEYER -AKTUALISIERT AM 13.08.2019-10:08
Pathophysiologien des Stuhl-Mikrobioms
Hier werden erst einmal nur die aus aktueller Forschung neu charakterisierten Pathologien erwähnt.
Die Signatur von menschlichen Eingeweiden die nicht an Clostridium difficile erkranken
Forscher haben die molekulare Signatur eines gesunden Darm-Mikrobioms gefunden – die Art von Bakteriengemeinschaft, die Clostridium difficile auch nach einer antibiotischen Behandlung in Schach hält.
Mithilfe der Massenspektrometrie analysierten die Forscher Tausende von Stoffwechsel-Nebenprodukten in Stuhlproben von Patienten. Insbesondere fanden sie hohe Konzentrationen einer Fettsäure namens 4-Methylpentansäure im Stuhl von Menschen mit C. difficile Krankheit. Die Fettsäure entsteht, wenn Proteine durch einen ungewöhnlichen Stoffwechselprozess zu Energieträgern abgebaut werden. Menschliche Zellen produzieren die Fettsäure nicht, und auch die meisten Bakterien im normalen Mikrobiom nicht – mit Ausnahme von C. difficile. Das Vorhandensein oder Fehlen der Fettsäure im Stuhl identifizierte Menschen mit C. difficile Krankheit mit einer Genauigkeit von 92,8 %.
Die Leber produziert Gallensäuren, um die Fettverdauung zu unterstützen. Sie werden dann in den Darm aufgenommen, wo sie von Teilen des Mikrobioms chemisch verändert werden. Die Forscher identifizierten einen Satz modifizierter Gallensäuren bei Menschen, die das Bakterium nicht oder nur in einer harmlosen Form trugen, das bei Menschen mit C. difficile Infektionen nicht vorhanden war. Diese ungewöhnlichen Gallensäuren könnten Marker von Menschen sein, die resistenter gegen C. difficile Infektionen sind.
Permissives Mikrobiom charakterisiert Menschen mit der neurovaskulären Erkrankung kavernöses Angiom
Kavernöse Angiome (KA) sind häufige vaskuläre Anomalien, die eine Hirnblutung verursachen. Auf der Grundlage von Studien an Mäusen wurden die Rolle gramnegativer Bakterien und eine veränderte Darmhomöostase in die Pathogenese von KA impliziert, und eine Pilotstudie hatte auf der Grundlage der 16S rRNA-Gensequenzierung auf mögliche Mikrobiomunterschiede zwischen Nicht-KA- und KA-Personen hingewiesen. Gewichtete Kombinationen von Mikrobiomsignaturen und Plasmaentzündungs-Biomarkern verstärken die Assoziationen mit der Schwere der Erkrankung und der Blutung. Dies ist der erste Nachweis eines sensitiven und spezifischen diagnostischen Mikrobioms bei einer menschlichen neurovaskulären Erkrankung. 33Sean P. Polster, Anukriti Sharma et al. Nature Communications, 27. Mai 2020, Permissive microbiome characterizes human subjects with a neurovascular disease cavernous angioma (Permissives Mikrobiom charakterisiert Menschen mit der neurovaskulären Erkrankung kavernöses Angiom) https://www.nature.com/articles/s41467-020-16436-w DOI: 10.1038/s41467-020-16436-w,34Studie: Darmbakterien könnten die Bildung von Kavernomen im Gehirn fördern, aerzteblatt.de, Montag, 15. Juni 2020, https://www.aerzteblatt.de/nachrichten/113262/Studie-Darmbakterien-koennten-die-Bildung-von-Kavernomen-im-Gehirn-foerdern
Erfahren Sie mehr dazu: Wie das Darm-Mikrobiom die Anti-Tumor-Immunfunktion der Leber kontrolliert. Ein Versuch die Mechanismen zu erkennen die zu manchen Leberkrebsarten führen. Clostridium scindens ist in der Lage, primäre Gallensäuren in toxische sekundäre Gallensäuren, und Glucocorticoide durch Seitenkettenspaltung in Androgene umzuwandeln.
Info-Krümel
01. Personalized Gut Mucosal Colonization Resistance to Empiric Probiotics Is Associated with Unique Host and Microbiome Features
06. September 2018, Cell
Die Resistenz gegen die Kolonisation von Darmschleimhaut durch Probiotika ist mit einzigartigen Wirts- und Mikrobiommerkmalen verbunden.
02. Post-Antibiotic Gut Mucosal Microbiome Reconstitution Is Impaired by Probiotics and Improved by Autologous FMT
06. September 2018, Cell
Die Rekonstitution des Mikrobioms des postantibiotischen Darms ist durch Probiotika beeinträchtigt und durch autologes FMT verbessert.
03. Functional Gut Microbiota Remodeling Contributes to the Caloric Restriction-Induced Metabolic Improvements
30. August 2018, Cell Metabolism
Funktionelle Darm-Mikrobiota-Remodellierung trägt zu den kalorienreduzierten metabolischen Verbesserungen bei.
04. Even on standardized diet, gut flora change from day to day
14. September 2018, Massachusetts Institute of Technology
Selbst bei standardisierter Ernährung verändert sich die Darmflora von Tag zu Tag.
05. Dietary fiber reduces brain inflammation during aging
14. September 2018, University of Illinois at Urbana-Champaign
Ballaststoffe reduzieren Hirnentzündungen während des Alterns.
06. Probiotic use may reduce antibiotic prescriptions
14. September 2018, Georgetown University Medical Center
Die Anwendung von Probiotika kann die Verschreibung von Antibiotika reduzieren.
07. „DARMAUFBAU“ NACH ANTIBIOTIKA – Probiotika – nicht immer sinnvoll und harmlos
11. September 2018, DAZ.online STUTTGART
08. An Inside Look at Probiotics – Do probiotics facilitate the recolonization of gut bacteria? A new study suggests the answer is not so simple
06.September 2018, Weizmann Institute of Science
Ein Einblick in Probiotika – Erleichtern Probiotika die Rekolonisation von Darmbakterien? Eine neue Studie zeigt, dass die Antwort nicht so einfach ist.
09. Gut microbiota utilize immunoglobulin A for mucosal colonization
18. Mai 2018 Science
Darm-Mikrobiota nutzen Immunglobulin A zur Kolonisierung der Schleimhäute.
10. Kalorienreduktion in der Ernährung, zwei neue Studien
02. September 2018 w3punkt.de
11. Kaiserschnitt: Vaginaler Mikrobentransfer fördert Darmflora der Neugeborenen
01. Februar 2016, Ärzteblatt
12. Partial restoration of the microbiota of cesarean-born infants via vaginal microbial transfer
01 Februar 2016 Nature Medicine
13. Stuhltransplantation hilft Krebspatienten
27. September 2018 Deutschlandfunk, Forschung Aktuell
14. Fecal microbiota transplantation helps restore beneficial bacteria in cancer patients
(Die Transplantation von fäkalen Mikrobiota hilft bei der Wiederherstellung nützlicher Bakterien bei Krebspatienten.)
26. September 2018, MedicalXpress
15. Fäkaler Mikrobiomtransfer – Die Gefahren der Stuhlübertragung
27. September 2018, Ärzte Zeitung online
16. Prebiotic effects of white button mushroom (Agaricus bisporus) feeding on succinate and intestinal gluconeogenesis in C57BL/6 mice
(Präbiotische Wirkung von weißem Champignon (Agaricus bisporus) bei der Fütterung; von Succinat und intestinaler Glukoneogenese bei C57BL/6 Mäusen) YuanTian et al., Journal of Functional Foods
Volume 45, June 2018, Pages 223-232, doi.org/10.1016/j.jff.2018.04.008
17. Microglial control of astrocytes in response to microbial metabolites
(Mikrogliale Kontrolle von Astrozyten als Reaktion auf mikrobielle Metaboliten, Veit Rothhammer et al. Nature 2018-03, en)
18. High-Fiber Diet Might Protect Against Range of Conditions Rita Rubin, MA, JAMA Network, April 2019 (Ballaststoffreiche Ernährung schützt vor einer Vielzahl von Erkrankungen)
19. The short chain fatty acid propionate stimulates GLP-1 and PYY secretion via free fatty acid receptor 2 in rodents. A. Psichas,et al., International Journal of Obesity Nr. 39. MacMillan Publishers, London, UK 2015, S. 424–429, doi:10.1038/ijo.2014.153. (Die kurzkettige Fettsäure Propionat stimuliert GLP-1 und PYYY Sekretion über den freien Fettsäure-Rezeptor 2 bei Nagetieren.)
20. Effects of targeted delivery of propionate to the human colon on appetite regulation, body weight maintenance and adiposity in overweight adults. Edward S. Chambers et al. In: Gut. Band 64, Nr. 11, 2015, S. 1744–1754, doi:10.1136/gutjnl-2014-307913 (englisch). (Auswirkungen der gezielten Verabreichung von Propionat an den menschlichen Dickdarm auf die Appetitregulation, die Erhaltung des Körpergewichts und die Adipositas bei übergewichtigen Erwachsenen)
21. Energy contributions of volatile fatty acids from the gastrointestinal tract in various species. E. N. Bergman, In: Physiological Reviews. Band 70, 1990, S. 567–590, PMID 2181501. (Energie-Beitrag seitens flüchtiger Fettsäuren aus dem Gastrointestinaltrakt bei verschiedenen Arten)
22. Wie Ballaststoffe und Darmbakterien den Herz-Kreislauf schützen. Max-Delbrück-Centrum für Molekulare Medizin in der Helmholtz-Gemeinschaft. Jutta Kramm, 13.12.2018
23. Short-Chain Fatty Acid Propionate Protects From Hypertensive Cardiovascular Damage. Hendrik Bartolomaeus et al., 12 Mar 2019, CIRCULATION (Die kurzkettige Fettsäure Propionat schützt vor hypertensiven kardiovaskulären Schäden.)
24. Regulation of immune cell function by short-chain fatty acids. R. Corrêa-Oliveira et al. In: Clinical & translational immunology. Band 5, Nummer 4, April 2016, doi:10.1038/cti.2016.17, Open Access. (Regulation der Immunzellfunktion durch kurzkettige Fettsäuren)
25. Microbial nitrogen limitation in the mammalian large intestine. Aspen T. Reese et al., Oktober 2018, Nature Microbiologyvolume 3, pages1441–1450 (Mikrobielle Stickstofflimitierung im Dickdarm von Säugetieren)
26. Dietary sugar silences a colonization factor in a mammalian gut symbiont Guy E. Townsend, PNAS January 2, 2019 116 (1) 233-238; first published December 17, 2018 https://doi.org/10.1073/pnas.1813780115 (Diätetischer Zucker bringt einen Kolonisationsfaktor in einem Darm-Symbiont von Säugetieren zum Schweigen.)
27. The short-chain fatty acid propionate increases glucagon and FABP4 production, impairing insulin action in mice and humans Amir Tirosh †, Ediz S. et al., Science Translational Medicine 2019-04
(Die kurzkettige Fettsäure Propionat erhöht die Glukagon- und FABP4-Produktion und beeinträchtigt die Insulinwirkung bei Mäusen und Menschen)
28. Propionsäure , Wikipedia 18.04.2019
29. Bacteroidetes, Wikipedia 19.04.2019
30. Stickstoffkreislauf Wikipedia 19.04.2019
31. Bacteroides thetaiotaomicron Wikipedia 19.04.2019
32. Adaptive Evolution within Gut Microbiomes of Healthy People
Shijie Zhao et al. April 2019 Cell Host & Microbe DOI:https://doi.org/10.1016/j.chom.2019.03.007
(Adaptive Evolution innerhalb von Darmmikrobiomen gesunder Menschen)
33. Veränderungen der Darmflora haben Einfluss auf Organe Gastroenterologe Christian Trautwein im Gespräch mit Carsten Schroeder, Dlf, 21.05. 2019
34. Discovery and inhibition of an interspecies gut bacterial pathway for Levodopa metabolism (Entdeckung und Hemmung eines die Arten übergreifenden Darmbakterienpfades für den Levodopa-Stoffwechsel) Vayu Maini Rekdal et al., Science 14. Jun 2019, DOI: 10.1126/science.aau6323
35. The human microbiome is a treasure trove waiting to be unlocked (Das menschliche Mikrobiom ist eine Schatzkammer, die darauf wartet, aufgeschlossen zu werden.) Vasu Appanna, Laurentian University, 14. Juli 2019 in The Conversation
36. Immunsystem reguliert Fettaufnahme durch Mikrobiom bei Mäusen, gie/aerzteblatt.de, 30. Juli 2019
37. T cell–mediated regulation of the microbiota protects against obesity, Charisse Petersen et al., Science 26 Jul 2019, DOI: 10.1126/science.aat9351
38. Potential roles of gut microbiome and metabolites in modulating ALS in mice, Eran Blacher et al., Nature 22 July 2019, doi: 10.1038/s41586-019-1443-5.
39. Darmbakterien könnten amyotrophe Lateralsklerose beeinflussen, rme/aerzteblatt.de, 24 Juli 2019.
40. Metabolomic networks connect host-microbiome processes to human Clostridioides difficile infections, (Metabolomische Netzwerke verbinden Wirtsmikrobiomprozesse mit menschlichen Clostridioiden difficilen Infektionen.) John I. Robinson et al., August 2019, JCI
41. The Landscape of Genetic Content in the Gut and Oral Human Microbiome (Die Landschaft des genetischen Gehalts im Darm und im oralen Mikrobiom des Menschen), Braden T. Tierney et al. Cell Host & Microbe AUGUST 2019, DOI:https://doi.org/10.1016/j.chom.2019.07.008
Die Texte in eventuell vorhandenen Tooltip-Fenstern entstammen der Wikipedia.
Es zeigt eine räumliche Struktur des intestinalen Bioms
Gleichzeitige Visualisierung von Schleim, reaktiven Mikroben mit FISH, Wirtsgewebe und aufgenommenen Lebensmitteln mit Carnoy-Fixierung und PFA-Fixierung.
Angrenzende 1 cm große Darmabschnitte wurden in Carnoy oder PFA fixiert, in Methacrylat eingebettet, geschnitten, parallel untersucht und mit identischen Bildeinstellungen aufgenommen.
Die im Mosaik gescannten Zusammenfassungsbilder (oben) zeigen die Position des Detailbildes (weißer Rahmen); Helligkeit und Kontrast wurden zur besseren Sichtbarkeit angepasst.
Die detaillierten Bilder (unten) zeigen ein großes Lebensmittelpartikel in der Nähe der Schleimhaut. Die Bilder wurden einer linearen Entmischung unterzogen und sind Projektionen von maximaler Intensität von bis zu 5 Ebenen.
DAPI färbt Nukleinsäuren, Weizenkeimagglutinin (WGA) färbt Schleim, und die Eub338-Sonde ist mit den meisten Bakterien hybridisiert. Skalenbalken =200 μm.
MD5: 6189de54f9332d0c6756973074b0fa1c
- Stoffwechsel- und Gehirnerkrankungen, Fruchtzucker und DHA
- Relevantes zu Saluto- und Pathogenese
- Die Bedeutung des menschlichen Mikrobioms für die mentale Gesundheit
- Kalorienreduktion in der Ernährung, zwei neue Studien
- Jüngste Fortschritte in der mikrobiellen Fermentation für Milchprodukte und Gesundheit
- Erst Opfer, später Angreifer?
- Der kluge Bauch – Unser zweites Gehirn
- Einflussfaktoren auf Gesundheit, Leistungsfähigkeit und Wohlbefinden
- Der Verzehr von niedrig dosiertem Aspartam und Stevia mit einer obesogenen Ernährung verändert den Stoffwechsel, die Darmmikrobiota und das mesolimbische Belohnungssystem in Rattenmüttern und ihren Nachkommen
- Fermentierte Lebensmittel: Warum der Verzehr von Sauerkraut Ihrem Darm hilft, gesund zu bleiben
Quellen und Tiefen
- 1„Es gibt noch große Wissenslücken. „Man liest immer wieder, dass das Mikrobiom eine Masse von 1 bis 2 Kilogramm hat – das stimmt nicht, es sind 200 bis 300 Gramm. Man liest auch immer, die Anzahl der Bakterien im Körper übersteigt die der Körperzellen um das 10-Fache – das stimmt auch nicht, das ist etwa eine 1 zu 1-Relation.“ – Prof. Dr. Thomas Frieling. In „Gesunde Snacks: Mit der Ernährung lässt sich positiv auf das Darmmikrobiom einwirken – aber in wieweit lassen sich daraus Empfehlungen ableiten?“ Ute Eppinger, 25. Juli 2022, https://deutsch.medscape.com/artikelansicht/4911409
- 2Hinrichsen F, Hamm J, Westermann M, … Rosenstiel P, Sommer F. Microbial regulation of hexokinase 2 links mitochondrial metabolism and cell death in colitis. Cell Metabolism (2021
https://doi.org/10.1016/j.cmet.2021.11.004 Precision Medicine in Chronic Inflammation - 3„Nichtsdestotrotz gibt es natürlich Marker für ein Mikrobiom beim Gesunden, z. B. die Reichhaltigkeit der Bakterien. Wenn ein Gesunder durchschnittlich 300-500 Bakterienspezies hat und ein Morbus-Crohn-Patient hat nur noch 30, dann ist das dramatisch weniger.“ – Prof. Dr. Dirk Haller In „Gesunde Snacks: Mit der Ernährung lässt sich positiv auf das Darmmikrobiom einwirken – aber in wieweit lassen sich daraus Empfehlungen ableiten?“ Ute Eppinger, 25. Juli 2022, https://deutsch.medscape.com/artikelansicht/4911409
- 4The Skin Microbiome of Cohabiting Couples Ashley A et al. July 2017 American Society for Microbiology Journals https://doi.org/10.1128/mSystems.00043-17 Creative Commons Attribution 4.0 International license Abgesehen von der Übersetzung wurden keine größeren Veränderungen vorgenommen
- 5Cohabiting family members share microbiota with one another and with their dogs Se Jin Song et al. April 2013 doi: 10.7554/eLife.00458 US National Library of Medicine
National Institutes of Health,
Creative Commons Attribution 3.0 Unported (CC BY 3.0) - 6Close social relationships correlate with human gut microbiota composition Kimberly A. Dill-McFarland et al. Januar 2019 Scientific Reports DOI https://doi.org/10.1038/s41598-018-37298-9 Open Access Creative Commons Attribution 4.0 International Außer geringfügigen übersetzungsbedingten Modifikationen, kein Änderungen
- 7
- 8Genome-wide association study in 8,956 German individuals identifies influence of ABO histo-blood groups on gut microbiome, Nature Genetics, 18 Januar 2021
- 9Wie der Darm das Gehirn vor Infektionen schützt | The Gut Trains the Immune System to Protect the Brain | Der Darm trainiert das Immunsystem zur Verteidigung des Gehirns | https://neurosciencenews.com/gut-immune-brain-17249/ | Gut-educated IgA plasma cells defend the meningeal venous sinuses | Published in Nature: 04 November 2020 | https://www.nature.com/articles/s41586-020-2886-4
- 10Immunsystem hält Darmflora im Gleichgewicht https://www.unibe.ch/aktuell/medien/media_relations/medienmitteilungen/2021/medienmitteilungen_2021/immunsystem_haelt_darmflora_im_gleichgewicht/index_ger.html
- 11Tim Rollenske, Sophie Burkhalter, Lukas Muerner, Stephan von Gunten, Jolanta Lukasiewicz, Hedda Wardemann and Andrew J. Macpherson: Parallelism of intestinal secretory IgA shapes functional microbial fitness, Nature, 13 October 2021. doi: 10.1038/s41586-021-03973-7 https://www.nature.com/articles/s41586-021-03973-7
- 12Skin and gut imprinted helper T cell subsets exhibit distinct functional phenotypes in central nervous system autoimmunity. Nat Immunol 22, 880–892 (2021).
https://doi.org/10.1038/s41590-021-00948-8 - 13Botengänger zwischen Darm und Gehirn, Technische Universität München, 06.09.2021
- 14Commensal Microbiota Modulation of Natural Resistance to Virus Infection, Kailyn L. Stefan, Myoungjoo V. Kim, Akiko Iwasaki, Dennis L. Kasper, Published:November 18, 2020DOI:https://doi.org/10.1016/j.cell.2020.10.047 | Antiviral Defense from the Gut, Study looks at gut bacteria role in resistance to viral infections, By EKATERINA PESHEVA November 18, Harvard Medicine School 2020 Research
- 15Pan L, Mu M, Yang P, et al. ClinicalDie Andockstellen des Coronavirus finden sich in besonders hoher Dichte in den Enterozyten der Darmschleimhaut. Sie enthalten bei gesunden Menschen hohe Konzentrationen von ACE2Characteristics of COVID-19 Patients With Digestive Symptoms in Hubei, China: A Descriptive, Cross-Sectional, Multicenter Study. Am J Gastroenterol 2020
- 16Hoffmann M, Kleine-Weber H, Schroeder S, et al. SARS-CoV-2 Cell Entry Depends on ACE2and TMPRSS2 and Is Blocked by a Clinically Proven Protease Inhibitor. Cell 2020;181:271-280e8
- 17Patankar JV, Chiriac M, Lehmann M, Kühl AA, Atreya R, Becker C, The
SARS-CoV-2 attachment receptor ACE2 is decreased in Crohn’s disease and regulated by microbialand inflammatory signaling, Gastroenterology (2020), doi: https://doi.org/10.1053/j.gastro.2020.10.021 - 18IDW 27.11.2020 15:18 Wo das Coronavirus im Darm andockt, Susanne Langer Kommunikation und Presse Friedrich-Alexander-Universität Erlangen-Nürnberg
- 19Darmbakterien verbessern Prognose von Typ-2-Diabetes, Dr. Ulrich Marsch Corporate Communications Center, Technische Universität München. Die Arbeit wurde im Rahmen eines Sonderforschungsbereichs der Deutschen Forschungsgemeinschaft (DFG SFB1371; https://www.sfb1371.tum.de/) und mit Mitteln des Bundesministeriums für Bildung und Forschung (BMBF/JPI DINAMIC) durchgeführt.
- 20Bakterien aus dem Fettgewebe führen zu Entzündungen, Peggy Darius, Stabsstelle Universitätskommunikation/Medienredaktion der Universität Leipzig 14.07.2020
- 21Adipose tissue derived bacteria are associated with inflammation in obesity and type 2 diabetes (Aus Fettgewebe stammende Bakterien sind mit Entzündungen bei Fettleibigkeit und Typ-2-Diabetes assoziiert), Gut microbiota, Original research, Lucas Massier, Rima Chakaroun, Shirin Tabei et al. 21. April 2020.
- 22Entzündung im Hirn. Wie ein Antibiotikum Depressions-Verhalten vermindert Ärzte Zeitung online 19.09.2019
- 23Minocycline alters behavior microglia and the gut microbiome in a trait-anxiety-dependent manner MinocyclinLeguminosen oder Hülsenfrüchte, zu denen Bohnen, Kichererbsen und Linsen gehören, sind eine gute Quelle für Proteine und Ballaststoffe und eine besonders unzureichend genutzte Nahrungsquelleverändert das Verhalten, die Mikroglia und das Darmmikrobiom in einer von der Eigenschaft Angst abhängigen Weise. Nature, Translational Psychiatry, 13 September 2019
- 24Mit kurzkettigen Fettsäuren das MS-Immunsystem normalisieren Ärztezeitung, 11.11.2019 Dr. Thomas Heim
- 25The Role of Dietary Fiber in Rheumatoid Arthritis Patients: A Feasibility Study https://www.mdpi.com/2072-6643/11/10/2392 (Die Rolle von Ballaststoffen in der Ernährung von Patienten mit rheumatoider Arthritis: Eine Machbarkeitsstudie), DOI: 10.3390/nu11102392
- 26Targeting zonulin and intestinal epithelial barrier function to prevent onset of arthritis https://www.nature.com/articles/s41467-020-15831-7 (Beeinflussung der Funktion von Zonulin und der epithelialen Barrierefunktion des Darms zur Verhinderung des Ausbruchs von Arthritis)
- 27Dieser Abschnitt zitiert ausgiebig aus der Pressemitteilung:Ballaststoffreiche Ernährung als Zusatzbehandlung für Arthritis? von Susanne Langer Kommunikation und Presse, Friedrich-Alexander-Universität Erlangen-Nürnberg
- 28Hinrichsen F, Hamm J, Westermann M, … Rosenstiel P, Sommer F. Microbial regulation of hexokinase 2 links mitochondrial metabolism and cell death in colitis. Cell Metabolism (2021
https://doi.org/10.1016/j.cmet.2021.11.004 Precision Medicine in Chronic Inflammation - 29
- 30Liu, HY., Giraud, A., Seignez, C. et al; Distinct B cell subsets in Peyer’s patches convey probiotic effects by Limosilactobacillus reuteri. Microbiome 9, 198 (2021). https://doi.org/10.1186/s40168-021-01128-4… https://rdcu.be/czjai
- 31Rasmussen TS, Mentzel CMJ, Kot W, et al
Faecal virome transplantation decreases symptoms of type 2 diabetes and obesity in a murine model
Gut Published Online First: 12 March 2020. doi: 10.1136/gutjnl-2019-320005 - 32CAN TRANSPLANTING POOP VIRUSES TREAT OBESITY AND DIABETES? MARIA HORNBEK-COPENHAGEN, FUTURITY 4. MAI 2020
- 33Sean P. Polster, Anukriti Sharma et al. Nature Communications, 27. Mai 2020, Permissive microbiome characterizes human subjects with a neurovascular disease cavernous angioma (Permissives Mikrobiom charakterisiert Menschen mit der neurovaskulären Erkrankung kavernöses Angiom) https://www.nature.com/articles/s41467-020-16436-w DOI: 10.1038/s41467-020-16436-w
- 34Studie: Darmbakterien könnten die Bildung von Kavernomen im Gehirn fördern, aerzteblatt.de, Montag, 15. Juni 2020, https://www.aerzteblatt.de/nachrichten/113262/Studie-Darmbakterien-koennten-die-Bildung-von-Kavernomen-im-Gehirn-foerdern